题目内容
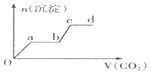
【题目】在1L0.1molNaAlO2和0.1mol Ba(NO3)2 的混合溶液中,逐滴加入浓度为0.1mol/L 的H2SO4 溶液,下列图象中能表示反应产生的沉淀的物质的量和所加入硫酸溶液的体积关系是(已知AlO2﹣和Ba2+可以大量共存)( )
A.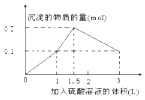
B.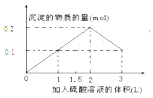
C.
D.
【答案】A
【解析】解:在1L含0.1mol NaAlO2和0.1mol Ba(OH)2的混合溶液中n(NaAlO2)=0.1mol,n[Ba(OH)2]=0.1mol,向该混合溶液中加入H2SO4溶液,首先发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O,Ba(OH)2反应完毕,继续加入H2SO4溶液,再发生反应AlO2﹣+H++H2O=Al(OH)3↓,AlO2﹣反应完毕,沉淀达最大,继续加入H2SO4溶液,发生反应Al(OH)3+3H+=Al3++3H2O,沉淀减少,Al(OH)3反应完毕,最后为BaSO4沉淀,继续加入H2SO4溶液,沉淀的量不变.第一阶段:由发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O可知,Ba(OH)2反应完毕,需加入0.1molH2SO4 , H2SO4溶液的体积为 ![]() =1L,生成沉淀n(BaSO4)=0.1mol;
=1L,生成沉淀n(BaSO4)=0.1mol;
第二阶段:由发生反应AlO2﹣+H++H2O=Al(OH)3↓可知,0.1molAlO2﹣反应完毕,该阶段需加入0.05molH2SO4 , H2SO4溶液的体积为 ![]() =0.5L,该阶段生成沉淀n[Al(OH)3]=0.1mol,但加入相同体积的硫酸,该阶段比第一阶段生成沉淀的多,为第一阶段的2倍;
=0.5L,该阶段生成沉淀n[Al(OH)3]=0.1mol,但加入相同体积的硫酸,该阶段比第一阶段生成沉淀的多,为第一阶段的2倍;
第三阶段:由发生反应Al(OH)3+3H+=Al3++3H2O可知,沉淀减少,0.1molAl(OH)3完全溶解,该阶段需加入 ![]() =0.15molH2SO4 , H2SO4溶液的体积为
=0.15molH2SO4 , H2SO4溶液的体积为 ![]() =1.5L,沉淀n(BaSO4)=0.1mol;
=1.5L,沉淀n(BaSO4)=0.1mol;
由上述分析可知:
第一阶段产生沉淀n(BaSO4)=0.1mol,加入H2SO4溶液的体积为1L;
第二阶段又生成沉淀n[Al(OH)3]=0.1mol,此时沉淀总量为0.2mol,该阶段加入H2SO4溶液的体积为0.1L,此时加入H2SO4溶液的总体积为1.5L;
第三阶段0.1molAl(OH)3完全溶解,此时沉淀n(BaSO4)=0.1mol,该阶段加入H2SO4溶液的体积为1.5L,此时加入H2SO4的总体积为3L.故沉淀的量与H2SO4溶液体积关系图为: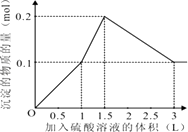 ,
,
故选A.

 阅读快车系列答案
阅读快车系列答案【题目】仔细分析下列表格中烃的排列规律,判断排列在第17位烃的分子式是( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | …… |
C2H2 | C2H4 | C2H6 | C3H4 | C3H6 | C3H8 | C4H6 | C4H8 | C4H10 | …… |
A. C6H12B. C6H14C. C7H12D. C7H14