题目内容
向10 mL 0.1mol/L NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的
| A.x=10时,溶液中有NH4+、Al3+、SO42—,且c(NH4+)>c(Al3+) |
| B.x=10时,溶液中有NH4+、AlO2—、SO42—,且c(NH4+)>c(SO42—) |
| C.x=30时,溶液中有Ba2+、AlO2—、OH—,且c(OH—)<c(AlO2—) |
| D.x=30时,溶液中有Ba2+、Al3+、OH—,且c(OH—) = c(Ba2+) |
A
解析试题分析:A、当x=10时,NH4Al(SO4)2与Ba(OH)2等物质的量反应,此时OH-量不足,OH-首先与Al3+反应,与NH4+不反应,所以溶液中有未参加反应的NH4+和部分剩余的Al3+存在,同时SO42-也有剩余,但此时不会有AlO2-生成,溶液中c(NH4+)>c(Al3+),故A正确;B、由A中分析可知,溶液中不会有AlO2-生成,溶液中有NH4+、Al3+、SO42-,参加反应的硫酸根离子为0.001mol,剩余0.001molSO42-,溶液中NH4+未参加反应,但溶液中NH4+水解,故c(NH4+)<c(SO42—),故B错误;C、当x=30时,0.001 mol的NH4Al(SO4)2与0.003 mol Ba(OH)2反应,生成0.002 mol BaSO4、0.001 mol NaAlO2、0.001 mol NH3?H2O,且剩余0.001 mol Ba2+和0.001 mol OH-,由于NH3?H2O也是一种碱,存在电离平衡:NH3?H2O NH4++OH-,使得溶液中c(OH—)大于0.001 mol,故c(OH—) >c(AlO2—),故C错误;D、由C中分析可知,溶液中含有Ba2+、AlO2-、OH-,其中溶液中c(OH-)大于0.001 mol,含有0.001 mol Ba2+,c(OH—)>c(Ba2+),故D错误,答案选A。
NH4++OH-,使得溶液中c(OH—)大于0.001 mol,故c(OH—) >c(AlO2—),故C错误;D、由C中分析可知,溶液中含有Ba2+、AlO2-、OH-,其中溶液中c(OH-)大于0.001 mol,含有0.001 mol Ba2+,c(OH—)>c(Ba2+),故D错误,答案选A。
考点:考查离子方程式的有关判断和计算

 阅读快车系列答案
阅读快车系列答案在pH=1的无色溶液中,下列各离子组因发生氧化还原反应而不能共存的是
| A.NH4+ K+ Na+ CO32- NO3- |
| B.K+ Na+ Fe2+ SO42- NO3- |
| C.NH4+ K+ Na+ HCO3-[Al(OH)4]- |
| D.NH4+ K+ Na+ NO3- I- |
向15mL 0.1mol/L Ba(OH)2溶液中,滴加等浓度NH4Al(SO4)2溶液x mL,下列叙述错误的是
| A.x=5时,溶液中有Ba2+、OH-、AlO2-,且OH-> AlO2- |
| B.x=7.5时,溶液中有NH4+、AlO2-,且NH4+=AlO2- |
| C.x=10时,溶液中有SO42-、NH4+,且H+> OH- |
| D.x=15时,溶液中有SO42-、NH4+、Al3+,且NH4+> Al3+ |
下列离子方程式不正确的是
| A.用FeCl3溶液腐蚀铜制线路板: Cu+2Fe3+==Cu2++2Fe2+ |
| B.用食醋清除水垢:2CH3COOH+CaCO3=Ca2++2CH3COO— +H2O +CO2↑ |
| C.含有氢氧化铝的胃药能降低胃酸:Al(OH)3 +3H+=Al3++3H2O |
| D.用惰性电极电解熔融氯化钠:2Cl-+2H2O ==Cl2↑+H2↑+2OH- |
下列离子方程式正确的是
| A.大理石溶于醋酸: CaCO3+2H+ =Ca2+ + CO2 ↑ +H2O |
| B.FeBr2溶液中通入少量的Cl2: Cl2+2Fe2+=2Fe3+ +2Cl- |
| C.向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全:2H++SO42- +Ba2+ +2OH- = BaSO4 ↓+ ↑2H2O |
| D.酸性氢氧燃料电池的正极反应: H2-2e- = 2H+ |
常温时向某溶液中滴入石蕊试液,溶液呈蓝色,其中可能大量共存的离子是
| A.Ag(NH3)2+、K+、Cl-、OH- | B.S2-、Na+、Cl-、ClO- |
| C.Al3+、K+、SO32-、S2- | D.Fe3+、Na+、Cl-、SO42- |
能正确表示下列各组溶液混合后,所得液体恰好呈中性的离子方程式是
| A.Ba(OH)2和NaHSO4:Ba2+ +2OH— +2H+ +SO42—→BaSO4↓+ 2H2O |
| B.Ba(OH)2和NaHSO4:Ba2+ + OH—+ H++ SO42—→BaSO4↓+ H2O |
| C.Ba(OH)2和KAl(SO4)2:2Ba2++ 4OH—+ Al3++ 2SO42—→2BaSO4↓+ AlO2— |
| D.Ba(OH)2和KAl(SO4)2:3Ba2+ + 6OH—+ 2Al3++ 3SO42—→3BaSO4↓+2Al(OH)3↓ |
某工业废水含有下列离子中的5种(不考虑水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,且各种离子的物质的量浓度相等。甲同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
根据上述实验,以下推测正确的是( )
| A.溶液中难以确定Al3+的存在与否 |
| B.原溶液中所含的离子为:Cu2+、Fe2+、Cl-、NO3-、SO42- |
| C.步骤②中可以确定Fe2+、NO3-的存在,不能确定其它离子的存在 |
| D.步骤③中的白色沉淀为2种钡盐 |
下列变化的离子方程式书写正确的是
A.将少量AgNO3溶液滴入氨水中: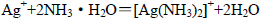 |
B.将少量SO2通入NaClO溶液中: |
C.澄清石灰水与稀硝酸反应: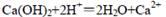 |
D.水玻璃长时间放置在空气中: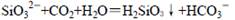 |