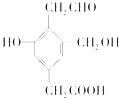
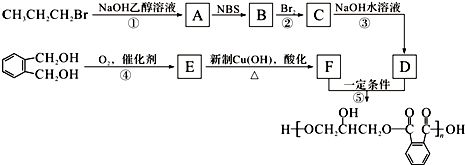
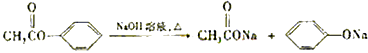题目内容
【题目】已知甲、乙、丙为常见单质,A、B、C、D、E、F、G、X均为常见的化合物;A、B、C、D、E、X等的焰色反应均呈黄色;B和X的摩尔质量相同,E的相对分子质量比D的相对分子质量大16。在一定条件下,各物质相互转化关系如下图所示:

(1)写出X和G的化学式:X ________ ,G ________。
(2)写出有关变化的化学方程式:
D+丙:_______________________________________。
C+G:______________________________________。
(3)写出B与H2O反应的离子方程式:____________________________________;若消耗0.5mol B转移电子________mol 。
【答案】 Na2S SO3 2Na2SO3+O2=2Na2SO4 SO3+2NaOH=Na2SO4+H2O 2Na2O2+2H2O=4Na++4OH-+O2↑ 0.5
【解析】单质甲、乙均能与单质丙连续两次反应,可能是单质甲、乙分别被氧气连续氧化,生成不同的氧化物,则丙为氧气,氧化物与水反应放出氧气,则B是过氧化钠;C是氢氧化钠,A是氧化钠,甲为钠;又因为B和X的摩尔质量相同,则X为硫化钠,那么乙为硫,F为二氧化硫,G是三氧化硫;从而进一步推断出D为亚硫酸钠、E是硫酸钠,而硫酸钠的相对分子质量比亚硫酸钠的相对分子质量大16,符合题意;
(1)X为硫化钠,化学式Na2S;G为三氧化硫,化学式SO3;正确答案:Na2S、SO3。
(2)D为亚硫酸钠,丙为氧气,亚硫酸钠被氧气氧化为硫酸钠,化学方程式:2Na2SO3+O2=2Na2SO4;C为氢氧化钠,G为三氧化硫,氢氧化钠与三氧化硫反应生成硫酸钠和水,化学方程式:SO3+2NaOH=Na2SO4+H2O;正确答案:2Na2SO3+O2=2Na2SO4;SO3+2NaOH=Na2SO4+H2O。
(3)B是过氧化钠与水反应生成氢氧化钠和氧气,反应的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑;该反应转移电子2 mol,消耗Na2O22 mol,现消耗0.5mol Na2O2转移电子0.5mol ;正确答案:2Na2O2+2H2O=4Na++4OH-+O2↑;0.5。