题目内容
10.下列变化对应的导电性有先增大后减小趋势的是( )| A. | 将金属钠投入到纯水中 | B. | 将烧碱投入到自来水中 | ||
| C. | 向澄清石灰水中通入二氧化碳 | D. | 向醋酸溶液中滴加氨水 |
分析 溶液的导电性和电解质里边自由移动离子的浓度大小有关,根据反应前后溶液导电物质的变化确定自由移动离子浓度的变化,进而得到导电性的变化趋势.
解答 解:A、金属钠和水反应生成氢氧化钠,从导电的水到氢氧化钠溶液,导电性增大,故A错误;
B、将烧碱投入到自来水中形成氢氧化钠溶液,从导电的水到氢氧化钠溶液,导电性增大,故B错误;
C、澄清的石灰水中通入二氧化碳,先是生成碳酸钙和水,二者的导电性明显弱于石灰水,但是过量的二氧化碳和碳酸钙、水之间反应生成易溶于水的碳酸氢钙,导电性明显增强导电性先减小后增加趋势,故C错误;
D、向醋酸溶液中滴加氨水,显示反应生成醋酸铵,导电性增强,继续加氨水会将醋酸铵稀释,浓度减小,所以导电性减弱,即导电性有先增大后减小趋势,故D正确.
故选D.
点评 本题考查学生电解质溶液的导电性强弱的判断,注意溶液的导电性和电解质里边自由移动离子的浓度大小有关,难度中等.

练习册系列答案
相关题目
18.下列叙述不正确的是( )
| A. | 将w g a%的NaCl溶液蒸发掉$\frac{w}{2}$g水,得到2a%的NaCl溶液 | |
| B. | 将1体积c mol/L的硫酸用水稀释为5体积,稀溶液的物质的量浓度为0.2c mol/L | |
| C. | 将5.85 g NaCl晶体溶于水配成1L溶液,制得0.01 mol/L的NaCl溶液 | |
| D. | 1 mol•L-1 AlCl3溶液中Cl-的物质的量浓度与3 mol•L-1NH4Cl溶液中Cl-的物质的量浓度相等 |
5.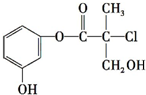 现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是( )
现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是( )
 现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是( )
现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是( )| A. | 该有机物与溴水发生加成反应 | |
| B. | 该有机物与浓硫酸混合加热可发生消去反应 | |
| C. | 该有机物经催化氧化后能发生银镜反应 | |
| D. | 1mol该有机物与足量NaOH溶液反应最多消耗3molNaOH |
15.人体内所必需的下列元素中,因摄入量不足而导致骨质疏松的是( )
| A. | K | B. | Ca | C. | Na | D. | F |
2.下列说法正确的是( )
| A. | 盐类发生水解的过程中,溶液的pH一定发生改变 | |
| B. | 向K2CO3溶液中通入CO2可使溶液中的c(CO32-)变大 | |
| C. | 向Na2SO3溶液中通入Cl2,溶液的导电性变强 | |
| D. | 一定温度下的密闭容器中,反应2NO2?N2O4达平衡时,再加入1molN2O4,平衡正向移动,且N2O4含量增大 |
19.下列各组离子,能在指定溶液中一定能大量共存的是( )
| A. | 含有大量Fe3+的溶液:Na+、SCN-、Cl-、I- | |
| B. | 中性溶液:Fe3+、Al3+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | 常温下,pH=12的溶液:Na+、K+、Cl-、SO${\;}_{4}^{2-}$ | |
| D. | 与铝粉反应放出H2的无色溶液:Br-、Al3+、Na+、SO${\;}_{4}^{2-}$ |
20.在密闭容器中,A和B反应生成C,其反应速率分别用v(A)、v (B)、v (C)表示,已知它们之间的如下关系:3v (A)=2v (B),3v (C)=2v (B).则此反应可表示为( )
| A. | 3A+2B=2C | B. | 2A+3B=2C | C. | 3A+2B=3C | D. | A+B=C |