题目内容
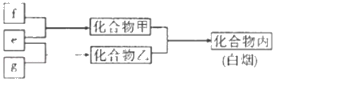
【题目】铬及其化合物在生产生活中具有十分广泛的用途。工业上以铬铁矿(主要成分是Fe(CrO2)2,Cr元素为+3价。含少量MgCO3、Al2O3、SiO2等杂质)为原料制取铬酸钠(Na2CrO4)晶体,其工艺流程如图:
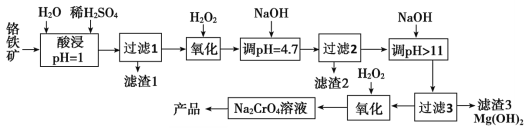
已知:+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO![]() 形式存在且易被氧化。
形式存在且易被氧化。
(1)如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成__。
(2)若省略“过滤2”步骤,产品中可能混有__(写化学式)。
(3)流程中两次使用了H2O2进行氧化,第二次氧化时反应的离子方程式为__。
(4)制取铬酸钠后的酸性废水中含有Cr2O![]() ,必须经过处理与净化才能排放。在废水中加入焦炭和铁屑,与酸性Cr2O
,必须经过处理与净化才能排放。在废水中加入焦炭和铁屑,与酸性Cr2O![]() 溶液形成原电池,使Cr2O
溶液形成原电池,使Cr2O![]() 转化为Cr3+,再用石灰乳对Cr3+进行沉降。该电池的正极反应式为__;沉降Cr3+的离子方程式为__,该反应的K=__(列出计算式)。(已知Ksp[Ca(OH2)]=8×10-6,Ksp[Cr(OH)3]=6.3×10-31)
转化为Cr3+,再用石灰乳对Cr3+进行沉降。该电池的正极反应式为__;沉降Cr3+的离子方程式为__,该反应的K=__(列出计算式)。(已知Ksp[Ca(OH2)]=8×10-6,Ksp[Cr(OH)3]=6.3×10-31)
(5)产品铬酸钠可用如图所示方法冶炼铬。
![]()
②的化学方程式为__,在实验室中引发该反应用到的两种药品是__(填化学式)。
【答案】FeOCr2O3 Na[Al(OH)4] 2CrO![]() +3H2O2+2OH-=2CrO
+3H2O2+2OH-=2CrO![]() +4H2O Cr2O
+4H2O Cr2O![]() +6e-+14H+=2Cr3+7H2O 2Cr3++Ca(OH)2=Cr(OH)3+3Ca2+
+6e-+14H+=2Cr3+7H2O 2Cr3++Ca(OH)2=Cr(OH)3+3Ca2+ ![]() Cr2O3+2Al
Cr2O3+2Al![]() 2Cr+Al2O3 KClO3、Mg
2Cr+Al2O3 KClO3、Mg
【解析】
根据化合物中化合价代数和为0,求出Fe元素的化合价,写出氧化物形式;根据氢氧化铝的两性写出杂质的化学式;根据题中图示,判断第二次双氧水氧化CrO2-成为CrO42-,写出离子方程式;根据原电池的正极发生还原反应,写出电极反应,由Cr3+与碱反应生成Cr(OH)3沉淀,写出离子方程式,由离子方程式写出K表达式,根据题中给出的Ksp值求算K值;根据铝热反应写出化学方程式,以此解答。
(1)铬铁矿主要成分是Fe(CrO2)2,Cr元素为+3价,O元素为-2价,设Fe元素化合价为x,由化合物中化合价代数和为0可知,x+3×2=2×2×2,x=+2,Fe元素为+2价,则Fe(CrO2)2可写成FeO·Cr2O3;答案为FeO·Cr2O3。
(2)Al(OH)3溶于强碱,如果把“过滤2”步骤省略,则pH>11时,Al(OH)3会溶解,引入杂质离子Al(OH)4-,生成Na[Al(OH)4],使产品不纯;答案为Na[Al(OH)4]。
(3)H2O2第二次氧化CrO2-,使它变为CrO42-,则Cr元素失电子,化合价升高,H2O2中的氧元素得电子,化合价降低,则反应离子方程式为:2CrO2-+3H2O2+2OH=2CrO42-+4H2O;答案为2CrO2-+3H2O2+2OH=2CrO42-+4H2O。
(4)在原电池的正极上发生得电子的还原反应,即Cr2O![]() 得电子转化为Cr3+,电极反应为Cr2O72-+6e-+14H+=2Cr3++7H2O,用石灰乳对Cr3+进行沉降,沉降Cr3+的离子方程式为:2Cr3++3Ca(OH)2=3Ca2++2Cr(OH)3↓, 由2Cr3++3Ca(OH)2=3Ca2++2Cr(OH)3↓可知,K=
得电子转化为Cr3+,电极反应为Cr2O72-+6e-+14H+=2Cr3++7H2O,用石灰乳对Cr3+进行沉降,沉降Cr3+的离子方程式为:2Cr3++3Ca(OH)2=3Ca2++2Cr(OH)3↓, 由2Cr3++3Ca(OH)2=3Ca2++2Cr(OH)3↓可知,K=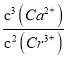 ,根据Ca(OH)2
,根据Ca(OH)2![]() Ca2++2OH-,Ksp[Ca(OH2)]=c(Ca2+)×c2(OH-),c(Ca2+)=
Ca2++2OH-,Ksp[Ca(OH2)]=c(Ca2+)×c2(OH-),c(Ca2+)=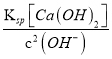 =
=![]() ,Cr(OH)3
,Cr(OH)3![]() Cr3++3OH-Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-),c(Cr3+)=
Cr3++3OH-Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-),c(Cr3+)=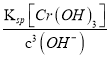 =
=![]() ,则K=
,则K=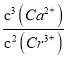 =
=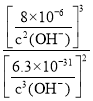 =
= ![]() ;答案为Cr2O72-+6e-+14H+=2Cr3++7H2O,2Cr3++3Ca(OH)2=3Ca2++2Cr(OH)3↓,
;答案为Cr2O72-+6e-+14H+=2Cr3++7H2O,2Cr3++3Ca(OH)2=3Ca2++2Cr(OH)3↓,![]() 。
。
(5)由于Cr2O3熔点很高,Al的金属性比Cr强,利用铝热反应制取Cr,即Cr2O3+2Al![]() Al2O3+2Cr,实验室引发铝热反应常用Mg和KClO3,其中镁条为引燃剂,氯酸钾为助燃剂;答案为Cr2O3+2Al
Al2O3+2Cr,实验室引发铝热反应常用Mg和KClO3,其中镁条为引燃剂,氯酸钾为助燃剂;答案为Cr2O3+2Al![]() Al2O3+2Cr,Mg、KClO3。
Al2O3+2Cr,Mg、KClO3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案