��Ŀ����
����Ŀ�����������е�һ�ֳ�����������;�dz��㷺��
��1��FeCl3��Һ���ڸ�ʴͭ��ӡˢ��·��,������Ӧ�����ӷ���ʽΪ___________��
��2������Ƥ��ȡ����۵ľֲ�����ͼ����:
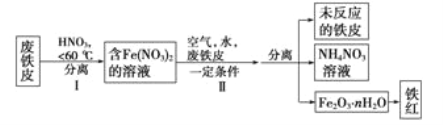
�ٲ���1�¶Ȳ���̫�ߵ�ԭ����____________________________��
�ڲ�����з�����Ӧ��
4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3��nH2O+8HNO3
4Fe+10HNO3==4Fe( NO3)2+NH4NO3+3H20
��һ����Ӧ����������___________������������____________���ڶ�����Ӧÿ����1 molNH4NO3��ת�Ƶĵ�������_________��
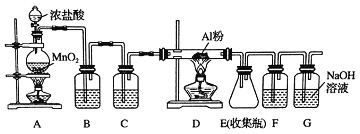
����������ں��Ӹֹ�,�䷴Ӧ�Ļ�ѧ����ʽΪ_______________��
����������������,�����е�Ԫ������Ҫ�Ĵ�����ʽΪ__________������ĸ)��
A.�������� B.����� C.�������� D.����
���𰸡� 2Fe3++Cu=2Fe2++Cu2+ �¶�̫�������ֽ� O2 FeO3��nH2O 8NA Fe2O3+2Al![]() Al2O3+2Fe B
Al2O3+2Fe B
����������1��FeCl3��Һ���ڸ�ʴͭ��ӡˢ��·���������Ȼ��������Ȼ�ͭ����Ӧ�����ӷ���ʽΪ2Fe3++Cu=2Fe2++Cu2+����ȷ����2Fe3++Cu=2Fe2++Cu2+��
��2��������ȶ����¶ȸ��������ֽ�����ȷ�𰸣��¶�̫�������ֽ⡣
�ڵ�һ����Ӧ����������������Fe(NO3)2������ΪFe2O3��nH2O������Fe2O3��nH2OΪ��������ڶ�����Ӧ�и�����Ԫ�صļ�̬�仯��֪�÷�Ӧת�Ƶ��ӵ���Ϊ8mol������8 NA ����ת��ʱ������1molNH4NO3����ȷ�𰸣�O2 �� FeO3��nH2O�� 8 NA��
������Ϊ����������������������ȷ�Ӧ�������ں��Ӹֹ�����Ӧ�Ļ�ѧ����ʽΪFe2O3+2Al![]() Al2O3+2Fe����ȷ����Fe2O3+2Al
Al2O3+2Fe����ȷ����Fe2O3+2Al![]() Al2O3+2Fe��
Al2O3+2Fe��
��ͨ������ͼ��֪�����������������������������е�Ԫ������Ҫ�Ĵ�����ʽ����ȷѡ��B ��

 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�����Ŀ��ij̽��С�����ñ�ͪ�������Ӧ(CH3COCH3��Br2![]() CH3COCH2Br��HBr)���о���Ӧ��Ũ���뷴Ӧ���ʵĹ�ϵ����Ӧ���� v(Br2) ͨ���ⶨ�����ɫ��ʧ�����ʱ����ȷ������һ���¶��£��������ʵ�����ݣ�
CH3COCH2Br��HBr)���о���Ӧ��Ũ���뷴Ӧ���ʵĹ�ϵ����Ӧ���� v(Br2) ͨ���ⶨ�����ɫ��ʧ�����ʱ����ȷ������һ���¶��£��������ʵ�����ݣ�
ʵ����� | ��ʼŨ��c/mol��L��1 | ����ɫ��ʧ����ʱ��t/s | ||
CH3COCH3 | HCl | Br2 | ||
�� | 0.80 | 0.20 | 0.0010 | 290 |
�� | 1.60 | 0.20 | 0.0010 | 145 |
�� | 0.80 | 0.40 | 0.0010 | 145 |
�� | 0.80 | 0.20 | 0.0020 | 580 |
����ʵ���������ó��Ľ�������ȷ����(����)
A������c(CH3COCH3)��v(Br2)����
B��ʵ��ں͢۵�v(Br2)���
C������c(HCl)��v(Br2)����
D������c(Br2)��v(Br2)����
����Ŀ���״�������Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϣ����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״�����������Ҫ��Ӧ���£�
��CO��g��+2H2��g��![]() CH3OH��g�� ��H1
CH3OH��g�� ��H1
��CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g�� ��H2
CH3OH��g��+H2O��g�� ��H2
��CO2��g��+H2��g��![]() CO��g��+H2O��g�� ��H3
CO��g��+H2O��g�� ��H3
�ش��������⣺
��1����֪��Ӧ���е���صĻ�ѧ�������������£�
��ѧ�� | H��H | C��O | C��O | H��O | C��H |
E/( kJmol-1) | 436 | 343 | 1076 | 465 | 413 |
�ɴ˼�����H1=______����֪��H2=��58 kJmol-1������H3=______��
��2���ϳ����е������Ƿ�չ�е�����Դ���������ð����Ʊ��������Ӧ���������ڡ���������ȣ�������Ϊȼ�ϵ��ŵ���__________________________________________________________��д�����㣩��ȱ����______________________________________________________________________��д�����㣩��