题目内容
【题目】(1)熔融盐燃料电池具有高的发电效率,因而受到重视。可用熔融的碳酸盐作为电解质,向负极充入燃料气CH4,用空气与CO2的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。工作过程中,CO![]() 移向________极(填“正”或“负”),已知CH4发生反应的电极反应式为_____________________________,则另一极的电极反应式为___________________________ 。
移向________极(填“正”或“负”),已知CH4发生反应的电极反应式为_____________________________,则另一极的电极反应式为___________________________ 。
(2)某实验小组同学对电化学原理进行了一系列探究活动。
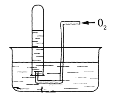
1)如图为某实验小组设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
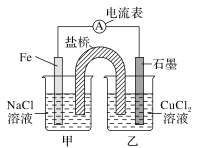
2)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,
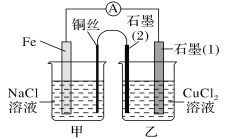
一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是________________,电极反应为________________________;乙装置中石墨(1)为________极(填“正”“负”“阴”或“阳”),乙装置中与铜丝相连石墨(2)电极上发生的反应式为________________,产物常用________检验。
【答案】负 CH4+4CO32--8e-===5CO2+2H2O 2O2+8e-+4CO2=4CO32- 0.2 溶液变红 O2+2H2O+4e-===4OH- 阴 2Cl--2e-===Cl2↑ 湿润的淀粉碘化钾试纸
【解析】
(1)熔融碳酸盐CH4燃料电池中,负极上CH4失去电子生成CO2,燃料电池中正极上氧气得电子生成碳酸根离子,结合电子守恒、电荷守恒写出电极反应式,原电池工作时阴离子向负极移动;
(2)①电池反应式为Fe+Cu2+=Cu+Fe2+,负极上质量减少、正极上质量增加,两个电极质量差为Cu电极增加的质量加上Fe减少的质量;
②其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,甲为原电池、乙为电解池,甲中Fe作负极、Cu作正极,甲中Cu电极上发生反应O2+4e-+2H2O+═4OH-,导致溶液碱性增强,酚酞遇碱变红色;乙装置中石墨(1)为阴极,连接铜丝的石墨为阳极,阳极上氯离子失电子发生氧化反应。
(1)熔融碳酸盐CH4燃料电池中,阴离子向负极移动,即甲装置中CO32-向负极移动;燃料电池中负极上CH4失去电子生成CO2,电极反应式为:CH4+4CO32--8e-═5CO2+2H2O,正极上氧气得电子生成碳酸根离子,电极反应式为:2O2+8e-+4CO2=4CO32-;
(2)①设计的原电池装置的自发氧化还原反应是:Fe+Cu2+=Cu+Fe2+,设电子转移量是x,则64×0.5x+56×0.5x=12,解得x=0.2;
②其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,甲为原电池、乙为电解池,
甲中Fe作负极、Cu作正极,甲中Cu电极上发生反应O2+4e-+2H2O═4OH-,导致溶液碱性增强,酚酞遇碱变红色,所以溶液变红色;乙装置中石墨(1)为阴极,连接铜丝的石墨(2)为阳极,阳极上氯离子失电子发生氧化反应,电极反应式为2Cl--2e-═Cl2↑,Cl2可用湿润的淀粉碘化钾试纸检验。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为_______________________。
(2)滤渣1的主要成分除SiO2外还有___________;氧化除杂工序中ZnO的作用是____________,若不通入氧气,其后果是________________。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为_________________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为______________;沉积锌后的电解液可返回_______工序继续使用。