题目内容
常温下,pH=13的强碱溶液和pH=2的强酸溶液混合,所得溶液的pH=11,则强碱溶液和强酸溶液的体积之比为
| A.1∶9 | B.9∶1 | C.1∶11 | D.11∶1 |
A
解析试题分析:常温下,pH=13的强碱溶液和pH=2的强酸溶液中OH-和H+浓度分别是0.1mol/L和0.01mol/L。二者混合后所得溶液的pH=11,则是, 反应中强碱是过量的,反应后OH-的浓度是0.001mol/L,则0.001=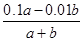 ,解得a:b=1:9,答案选A。
,解得a:b=1:9,答案选A。
考点:考查pH的有关计算

练习册系列答案
相关题目
常温下,将v1 mL c1 mol·L-1的氨水逐滴滴加到v2 mL c2 mol·L-1的盐酸中,下列结论中正确的是( )。
| A.若v1=v2 c1=c2,则混合液中c(NH4+)=c(C1-) |
| B.若混合液的pH=7,则混合液中c(NH4+)>c(C1-) |
| C.若v1=v2且pH<7,则一定有c1<c2 |
| D.若混合液的pH=7,则c1v1>c2v2 |
25℃时,等体积的 ① pH=2 H2SO4溶液 ②0.005mol/L Ba(OH)2溶液 ③pH=10 Na2CO3溶液④pH=4 NH4Cl溶液中,发生电离的水的物质的量之比是
| A.1:1:108:108 | B.108:108:1:106 |
| C.108: 5×107:1:106 | D.1:2:108:108 |
已知25℃时:
① NH4+ (aq) 十OH—(aq)=NH3·H2O(aq) ΔH=a kJ·mol-1
② NH4+ (aq) 十H2O(1)  NH3·H2O(aq)十H+(aq) ΔH=bkJ·mol-1
NH3·H2O(aq)十H+(aq) ΔH=bkJ·mol-1
向20 mL0.1mol/L氨水中逐滴加入0.1mol/L盐酸,下列有关说法正确的是( )
| A.随着盐酸的逐滴加入,水电离的c(OH—)总是逐渐减小 |
| B.当滴入10mL盐酸时,溶液中:c(NH4+)十c(NH3·H2O)=2c(Cl—) |
| C.当滴入20mL盐酸时,溶液中:c(Cl—)十c(H+)=c(NH4+)十c(OH—) |
D.水电离过程的热化学方程式可表示为:H2O(1)  H+(aq)+OH—(aq) ΔH=( b-a) kJ·mol-1 H+(aq)+OH—(aq) ΔH=( b-a) kJ·mol-1 |
25℃时,某物质的溶液中,由水电离出的c(H+)=1×10-5mol·L-1,下列说法一定正确的是
| A.该溶液的溶质是碱 | B.该溶液显碱性 |
| C.该溶液的溶质是酸 | D.该溶液的溶质是盐 |
下列说法正确的是
| A.在蒸馏水中滴加浓H2SO4,Kw不变 |
| B.CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
| D.在Na2S稀溶液中,c(H+)-c(OH-) = c(HS-) +2 c(S2-)-c(Na+) |
25℃时,水溶液中c(H+)与c(OH-)的变化关系如图中曲线a c所示,下列判断错误的是
| A.a c曲线上的任意一点都有c(H+)·c(OH-)=10-14 |
| B.b d线段上任意一点对应的溶液都呈中性 |
| C.d点对应溶液的温度高于25℃,pH<7 |
| D.CH3COONa溶液不可能位于c点 |
常温时,下列各溶液中,微粒的物质的量浓度关系正确的是
| A.pH = 5的NaHSO3溶液:[HSO3-]>[H2SO3]>[SO32-] |
| B.pH = 8的苯酚与苯酚钠混合溶液:[Na+]>[C6H5O-]>[OH-]>[H+] |
| C.pH = 7的CH3COONa与CH3COOH的混合溶液:[Na+]=[CH3COO-]+[CH3COOH] |
| D.0.1 mol/L NaHCO3溶液:[OH-] + [CO32-]= [H+]+[H2CO3] |
Na2SO3溶液做为吸收液吸收SO2时,吸收液pH随n( ): n(
): n( )变化的关系如下表:
)变化的关系如下表:
n( ): n( ): n( ) ) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
以下离子浓度关系的判断正确的是
A.NaHSO3溶液中c(H+) < c (OH-)
B.Na2SO3溶液中c(Na+)> c (
 )> c (
)> c ( ) > c (OH-) > c(H+)
) > c (OH-) > c(H+) C.当吸收液呈中性时,c(Na+) >c (
 ) > c (
) > c ( ) > c (OH-) = c(H+)
) > c (OH-) = c(H+) D.当吸收液呈中性时,c(Na+)>c (
 )+c (
)+c ( )
)