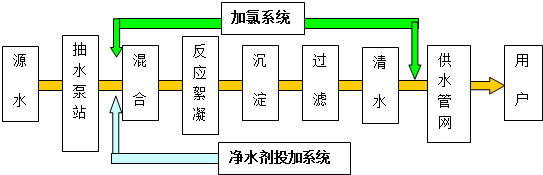
题目内容
现有某纯净气体A,取标准状况下体积均为2.24L的两份样品,一份与过量的O2混合,燃烧后无固体物质生成,气体生成物均被过量的澄清石灰水吸收,得到13.90g沉淀。另一份在标准状况下与一定质量的SO2气体混合(A不与SO2反应),测得混合气体对H2的相对密度为20。试推测A是什么?并写出A完全燃烧反应方程式。
A为CH3F 完全燃烧时的反应方程式为2CH3F+3O2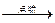 2CO2+2H2O+2HF
2CO2+2H2O+2HF
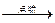 2CO2+2H2O+2HF
2CO2+2H2O+2HF①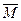 =20×2=40,故MA<40;
=20×2=40,故MA<40;
②A气体为0.1mol,若生成的气体为CO2,则生成CaCO3的沉淀质量应为10g,20g……显然与题意不符;
③若生成气体为SO2,生成CaSO3,其质量应为12g,24g……显然也与题目不相符;
④若既生成CaCO3沉淀又生成CaSO3沉淀,是否可行呢?也不行,因为A中若含C、S两元素,其相对分子质量已大于40;
⑤只能从Ca2+相应的难溶性盐进行思维发散:有CaF2、CaSiO3、Ca3(PO4)2等;
⑥思维辐合:CaSiO3、Ca3(PO4)2与题意不符,因为在燃烧时硅、磷变成了固体氧化物;
⑦只含F是不行的;
⑧很可能既含有C、又含有F的F卤代烃,且都只有一个原子(因受相对分子质量的制约);
⑨代入求算,生成的沉淀恰好为13.90g;
⑩最后确定A的分子式为CH3F。
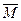 =20×2=40,故MA<40;
=20×2=40,故MA<40;②A气体为0.1mol,若生成的气体为CO2,则生成CaCO3的沉淀质量应为10g,20g……显然与题意不符;
③若生成气体为SO2,生成CaSO3,其质量应为12g,24g……显然也与题目不相符;
④若既生成CaCO3沉淀又生成CaSO3沉淀,是否可行呢?也不行,因为A中若含C、S两元素,其相对分子质量已大于40;
⑤只能从Ca2+相应的难溶性盐进行思维发散:有CaF2、CaSiO3、Ca3(PO4)2等;
⑥思维辐合:CaSiO3、Ca3(PO4)2与题意不符,因为在燃烧时硅、磷变成了固体氧化物;
⑦只含F是不行的;
⑧很可能既含有C、又含有F的F卤代烃,且都只有一个原子(因受相对分子质量的制约);
⑨代入求算,生成的沉淀恰好为13.90g;
⑩最后确定A的分子式为CH3F。

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
 HBr+HIO
HBr+HIO
 A、D
A、D