题目内容
2.目前,全世界镍的消费量仅次于铜、铝、铅、锌、居有色金属第五位,镍行业发展蕴藏着巨大的潜力.金属镍在电池、合金、催化剂等方面应用广泛.(1)下列关于金属及金属键的说法不正确的是a c
a.金属键具有方向性与饱和性
b.金属键是金属阳离子与自由电子间的相互作用
c.金属导电是因为在外加电场作用下产生自由电子
d.金属的熔沸点不同的原因是由于金属键强弱不同
e.金属的焰色是由于金属激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量
(2)雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,铝镍合金的结构如图1,与其结构相似的晶体是b(填字母).
a.氯化钠 b.氯化铯 c.碘晶体 d.金刚石

(3)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀.
①Ni2+的价层电子排布式为3d8.
②Ni2+可与丁二酮肟作用生成腥红色配合物沉淀如图2,配合物中碳原子的杂化类型为sp2、sp3.其中C、N、O
的第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(4)很多不饱和有机物在Ni催化下可与H2发生加成反应.如甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH).HCHO分子的立体结构为平面三角形,甲醇分子内的O-C-H键角小于甲醛分子内的O-C-H键角,原因是甲醇分子内C原子的杂化方式为sp3,O-C-H键角约为109°28′,甲醛分子内的C原子的杂化方式为sp2,O-C-H键角约为120°
(5)金属镍粉在CO气流中加热,生成无色挥发性液态Ni(CO)4,呈四面体构型,423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测:四羰基镍的晶体类型是分子晶体,Ni(CO)4易溶于下列b c(填字母).
a水 b四氯化碳 c苯 d 硫酸镍溶液.
分析 (1)金属键没有方向性和饱和性,金属键是金属阳离子和自由电子间的相互作用,金属导电是因为自由电子在外加电场作用下发生定向移动,金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱,金属的焰色是由于金属激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量;
(2)由图可知铝镍合金的晶胞结构中,Ni原子数目为1,Al原子数目为8×$\frac{1}{8}$=1,为AlNi,每个Ni原子周围有8个Al原子,每个Al原子周围有8个Ni原子,据此结合选项中各物质的晶胞结构判断;
(3)①Ni是28号元素,Ni2+核外有26个电子,根据核外电子排布规律书写,3d电子为其价电子;
②碳原子既有单键又有双键,因此杂化类型是sp2和sp3杂化;同一周期元素,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素;
(4)根据价层电子对互斥理论判断甲醛的空间构型;根据甲醇分子内C原子的杂化方式为sp3杂化,甲醛分子内的C原子的杂化方式为sp2杂化分析键角大小;
(5)沸点较低的晶体一般为分子晶体;根据相似相溶原理判断.
解答 解:(1)a.金属键不是存在于相邻原子之间的作用力,而是属于整块金属,因此没有方向性和饱和性,故a错误;
b.金属键是存在于金属阳离子和“自由电子”之间的强的相互作用,这些“自由电子”为所有阳离子所共用,其本质也是电性作用,故b正确;
c.金属键是存在于金属阳离子和“自由电子”,当给金属通电时,“自由电子”定向移动而导电,故c 错误;
d.金属键的强弱决定了金属晶体硬度、熔点,故d正确;
e.金属的焰色是由于激发态电子从能量较高的轨道跃迁到能量较低轨道时,能量以可见光的形式释放,故e正确;
故答案为:a c;
(2)由图可知铝镍合金的晶胞结构中,Ni原子数目为1,Al原子数目为8×$\frac{1}{8}$=1,为AlNi,每个Ni原子周围有8个Al原子,每个Al原子周围有8个Ni原子,
a.氯化钠中每个钠离子周围有6个氯离子,每个氯离子周围有6个钠离子,不符合,故a错误;
b.氯化铯中每个铯离子周围有8个氯离子,每个氯离子周围有8个铯离子,符合,故b正确;
c.碘晶体每个晶胞中有4个碘分子,每个碘分子含有两个I原子,所以每个晶胞中含有8个I原子,不符合,故c错误;
d.金刚石为空间立体网状结构,每C原子周围有4个C原子,不符合,故d错误;
故答案为:b;
(3)①Ni是28号元素,核外有28个电子,其原子核外电子排布为1s22s22p63s23p63d84s2,Ni2+核外有26个电子,价层电子排布式为3d8,
故答案为:3d8;
②腥红色配合物沉淀中碳原子既有单键又有双键,碳碳单键上的碳原子的杂化类型是sp2,碳碳双键上的碳原子的杂化类型是sp3杂化;同一周期元素,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,所以C、N、O三种元素的第一电离能大小顺序是N>O>C,
故答案为:sp2sp3;N>O>C;
(4)HCHO中碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,其空间构型是平面三角形;甲醇分子内C原子的杂化方式为sp3杂化,所以O-C-H键角约为109°28′,甲醛分子内的C原子的杂化方式为sp2杂化,O-C-H键角约为120°,所以甲醇分子内的O-C-H键角小于甲醛分子内的O-C-H键角,
故答案为:平面三角;甲醇分子内C原子的杂化方式为sp3,O-C-H键角约为109°28′,甲醛分子内的C原子的杂化方式为sp2,O-C-H键角约为120°;
(5)沸点较低的晶体一般为分子晶体,四羰基镍的晶体为分子晶体;Ni(CO)4呈四面体构型,为非极性分子,根据相似相溶原理可知,它易溶于四氯化碳和苯,选BC,
故答案为:分子晶体;b c.
点评 本题考查较为综合,题目难度中等,涉及金属键、核外电子排布规律、杂化、第一电离能、晶体性质等知识点,注意杂化、第一电离能是常考知识点,晶体结构为解答难点.

 小学期末标准试卷系列答案
小学期末标准试卷系列答案
:25℃时,以0.1mol/L金属离子测定得到如表数据:
| 物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS | Fe(OH)3 | |
| Ksp | 6×10-36 | 3×10-19 | ||||
| pH | 开始沉淀 | 4.7 | 7.2 | 1.9 | ||
| 沉淀完全 | 6.7 | 9.2 | 3.2 | |||
(1)步骤①常用热浓硫酸进行酸浸,写出酸浸时金属镍发生反应的化学方程式Ni+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NiSO4+SO2↑+2H2O.
(2)酸浸过程应控制酸的浓度、温度等条件,如图是镍的浸出率与温度的关系,温度高于100℃时,Ni2+浸出率降低的原因可能是温度超过100℃后,Ni2+的水解程度变大,生成更多Ni(OH)2.

(3)滤液l中含有0.8mol/LNi2+、0.1mol/LFe3+、0.1mol/LCu2+,步骤②的连续操作过程需要先分离出铁元素、铜元素,再制得镍硫化合物.为达到此目的,应先加NaOH将溶液调节至6.7≤pH<7.2(填pH的取值范围);再加_D(选填最佳试剂的序号).当溶液中Ni2+开始形成NiS时,c(Cu2+)1.6×10-17mol/L.(忽略溶液体积变化)
A.硝酸 B.氨水 C.A12S3 D.H2S
(4)步骤③生成的Ni(CO)4中碳的化合价与KCN中碳的化合价相同,则Ni(CO)4中Ni的化合价为0;工业上也常用NaClO氧化NiSO4,将制得的NiOOH热分解后进行还原得到Ni.ClO-在碱性条件下氧化Ni2+生成NiOOH的离子方程式为ClO-+2Ni2++4OH-=2NiOOH+H2O+Cl-.
(5)步骤⑥的目的是降低铝含量、获得多孔状的“海绵镍铝催化剂”,从而增强对氢气的吸附性,步骤⑥的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 灼热的炭与CO2反应 | ||
| C. | 铝与稀盐酸 | D. | 铝粉与氧化铁粉末反应 |
| A. | 放热反应 | B. | 吸热反应 | C. | 有催化剂作用 | D. | 无法判断 |
 某学生课外活动小组利用图所示装置做实验:在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅直至褪色,冷却后恢复红色,则原溶液可能是( )
某学生课外活动小组利用图所示装置做实验:在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅直至褪色,冷却后恢复红色,则原溶液可能是( )| A. | 溶有SO2的品红溶液 | B. | 滴有酚酞的氨水溶液 | ||
| C. | 滴有酚酞的NaOH溶液 | D. | 滴有石蕊的盐酸溶液 |
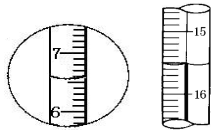
| A. | 左边是量筒读数6.5mL,右边是滴定管读数16.50mL | |
| B. | 左边是量筒读数7.5mL,右边是滴定管读数16.50mL | |
| C. | 左边是量筒读数6.5mL,右边是滴定管读数15.50mL | |
| D. | 左边是量简读数6.5mL,右边是滴定管读数16.50mL |
| A. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 | |
| B. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO | |
| C. | SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物 | |
| D. | 将浓硫酸滴到蔗糖表面,固体变黑膨胀,说明浓硫酸有脱水性和强氧化性 |

 .
.