题目内容
将0.2mol KMnO4在一定温度下加热后生成a mol O2:将剩余固体与过量浓盐酸混合加热又生成b mol Cl2,此时锰元素全部以Mn2+形式存在.若a+b=m,则m的值可能为( )
| A、0.35 | B、0.45 |
| C、0.55 | D、0.60 |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:在氧化还原反应中得失电子数相等,根据得失电子守恒结合极值法计算m值.
解答:
解:在氧化还原反应中得失电子数相等,所以反应过程中锰元素得到的电子数等于O元素、Cl元素失去的电子数,
所以0.2mol×(7-2)=4amol+2bmol,
1=4a+2b,
2a+b=0.5,
a+b=m=0.5-a,
当高锰酸钾不分解生成氧气时,a=0,当高锰酸钾完全分解生成氧气时,生成氧气的物质的量为0.1mol,所以a的取值范围为:0≤a≤0.1,
则0.5-0.1≤m≤0.5-0,即0.4≤m≤0.5,
故选B.
所以0.2mol×(7-2)=4amol+2bmol,
1=4a+2b,
2a+b=0.5,
a+b=m=0.5-a,
当高锰酸钾不分解生成氧气时,a=0,当高锰酸钾完全分解生成氧气时,生成氧气的物质的量为0.1mol,所以a的取值范围为:0≤a≤0.1,
则0.5-0.1≤m≤0.5-0,即0.4≤m≤0.5,
故选B.
点评:本题考查氧化还原反应的有关计算,根据电子守恒结合极值法进行分析解答即可,难度较大.

练习册系列答案
相关题目
下列各组微粒半径之比大于1的是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
在空气中放置,因发生氧化还原反应而变质的是( )
| A、Na |
| B、Na2O |
| C、Na2CO3 |
| D、NaOH |
下列所用除杂的试剂和操作方法均正确的是( )
| 选项 | 物质 | 杂质 | 所用试剂 | 操作方法 |
| ① | 乙烯 | 二氧化硫 | 氯水 | 洗气 |
| ② | 乙炔 | 硫化氢 | 氢氧化钠溶液 | 洗气 |
| ③ | 苯 | 苯酚 | 溴水 | 过滤 |
| ④ | 溴苯 | 液溴 | 氢氧化钠溶液 | 分液 |
| A、②④ | B、①④ | C、②③ | D、①③ |
将含有0.1mol明矾[KAl(SO4)2?12H2O]的溶液和100mL 2mol?L-1的Ba(OH)2溶液混合后,下列叙述正确的是( )
| A、反应完毕后,液体仍然澄清 |
| B、溶液浑浊,沉淀物是BaSO4 |
| C、生成0.1mol Al(OH)3和0.2mol BaSO4 |
| D、溶液浑浊,沉淀物是Al(OH)3 |
有机反应的类型很多,下列各反应中与CH2═CH2→CH2Br-CH2Br的变化属于同一反应类型的是( )
| A、C2H5Cl→CH2═CH2 |
| B、CH3CHO→C2H5OH |
C、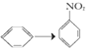 |
| D、CH3COOH→CH3COOC2H5 |
在无色透明的溶液中能大量共存的是( )
| A、HCO3-、Na+、OH-、Cl- |
| B、Ca2+、NO3-、SO42-、CO32- |
| C、Fe2+、Na+、H+、NO3- |
| D、Cl-、Mg2+、Na+、SO42- |
 )只有一种
)只有一种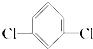 )只有一种.
)只有一种.