题目内容
下列判断错误的是
- A.沸点:NH3>AsH3>PH3
- B.熔点:Cs>Li>Na
- C.酸性:HClO4>H2SO4>H3PO4
- D.碱性:NaOH>Mg(OH)2>Al(OH)3
B
解析:
结构相似的氢化物,相对分子质量越大,其沸点越高,但由于氨气分子之间存在氢建,沸点较大,A正确;
碱金属单质的熔点是由金属键的强弱决定的,金属键越强,熔点越高,而对于金属键来说离子半径越小,离子所带电荷越多离子键越强,碱金属的离子均为+1价的阳离子,离子半径的大小关系为Cs+>Na+>Li+可见锂离子的半径最小,单质中锂的金属键最强熔点应该最高,所以熔点顺序应为Li>Na>Cs,B错误;
最高价氧化物对应水化物的酸性同一周期从左到右依次增强所以酸性HClO4>H2SO4 >H3PO4 正确;
氢氧化物的碱性同一周期从左到右依次减弱所以碱性NaOH>Mg(OH)2>Al(OH)3正确;
答案选B。
解析:
结构相似的氢化物,相对分子质量越大,其沸点越高,但由于氨气分子之间存在氢建,沸点较大,A正确;
碱金属单质的熔点是由金属键的强弱决定的,金属键越强,熔点越高,而对于金属键来说离子半径越小,离子所带电荷越多离子键越强,碱金属的离子均为+1价的阳离子,离子半径的大小关系为Cs+>Na+>Li+可见锂离子的半径最小,单质中锂的金属键最强熔点应该最高,所以熔点顺序应为Li>Na>Cs,B错误;
最高价氧化物对应水化物的酸性同一周期从左到右依次增强所以酸性HClO4>H2SO4 >H3PO4 正确;
氢氧化物的碱性同一周期从左到右依次减弱所以碱性NaOH>Mg(OH)2>Al(OH)3正确;
答案选B。

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
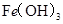
 分别在溶液中达到沉淀溶解平衡后,改变溶液
分别在溶液中达到沉淀溶解平衡后,改变溶液 ,金属阳离子浓度的辩护如图所示。据图分析,下列判断错误的是
,金属阳离子浓度的辩护如图所示。据图分析,下列判断错误的是

 固体可使溶液由
固体可使溶液由 点变到
点变到 点
点
 两点代表的溶液中
两点代表的溶液中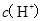 与
与 乘积相等
乘积相等 、
、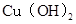 分别在
分别在 B.熔点:
B.熔点: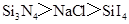
 D.碱性:
D.碱性: