题目内容
实验室中用锌和稀硫酸反应制取氢气。
(1)要制取3.36L(标准状况)气体,需要1 mol/L H2SO4多少毫升?
(2)某同学用向下排空气法收集氢气,测得所收集气体密度是纯氢气密度的1.2倍。求该气体中氢气所占的体积分数(设空气的平均相对分子质量为29)。
(1)要制取3.36L(标准状况)气体,需要1 mol/L H2SO4多少毫升?
(2)某同学用向下排空气法收集氢气,测得所收集气体密度是纯氢气密度的1.2倍。求该气体中氢气所占的体积分数(设空气的平均相对分子质量为29)。
(1)150毫升
(2)96.3%。
试题分析:(1)要制取3.36L(标准状况)气体,需要1 mol/L H2SO4多少毫升?
解: Zn+ H2SO4=ZnSO4+ H2↑ (2分)
1 mol 22.4L
n(H2SO4) 3.36L (1分)
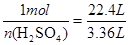 (1分)
(1分)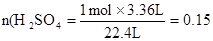 mol (1分)
mol (1分)0.15L×1000mL/L="150" mL (1分)
答:需要1 mol/L H2SO4150毫升
(2)某同学用向下排空气法收集氢气,测得所收集气体密度是纯氢气密度的1.5倍。求该气体中氢气所占的体积分数(设空气的平均相对分子质量为29)。
解:根据

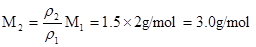 (2分)
(2分)设amol氢气中混有bmol空气。
则:
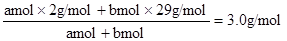 (2分)
(2分)解得a:b=26:1 (1分)
V(H2)%=n(H2)%=
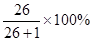 =96.3% (1分)
=96.3% (1分)答:该气体中氢气所占的体积分数为96.3%。

练习册系列答案
相关题目