题目内容
某温度下,把3mol A和2.5mol B混合,盛入容积为2L的容器内,使它们发生反应:3A(气)+B(气)?xC(气)+2D(气),经过5min后达到平衡生成1mol D,测得C的平均生成速率为0.10mol?L-1?min-1.下列叙述不正确的是( )A.x的值为2
B.B的转化率为20%
C.平衡常数为

D.A的平均消耗速率为0.15mol?L-1?min-1
【答案】分析:A.根据v= 计算v(D),利用速率之比等于化学计量数之比计算x的值;
计算v(D),利用速率之比等于化学计量数之比计算x的值;
B.根据D的物质的量利用方程式计算参加反应的B的物质的量,再根据转化率定义计算;
C.利用三段式计算平衡时各组分的平衡浓度,代入平衡常数表达式计算;
D.利用速率之比等于化学计量数之比计算v(A).
解答:解:A.5min后达到平衡生成1mol D,则v(D)=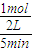 =0.10mol?L-1?min-1,速率之比等于化学计量数之比,故x:2=0.1:0.1,解得x=2,故A正确;
=0.10mol?L-1?min-1,速率之比等于化学计量数之比,故x:2=0.1:0.1,解得x=2,故A正确;
B.5min后达到平衡生成1mol D,由方程式可知参加反应的B为1mol× =0.5mol,故B的转化率为
=0.5mol,故B的转化率为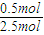 ×100%=20%,故B正确;
×100%=20%,故B正确;
C.5min后达到平衡生成1mol D,D的平衡浓度为0.5mol/L,则:
3A(气)+B(气)?2C(气)+2D(气),
开始(mol/L):1.5 1.25 0 0
变化(mol/L):0.75 0.25 0.5 0.5
平衡(mol/L):0.75 1 0.5 0.5
故该温度平衡常数k=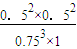 =
=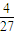 ,故C错误;
,故C错误;
D.速率之比等于化学计量数之比,故v(A)= v(C)=
v(C)= ×0.10mol?L-1?min-1=0.15mol?L-1?min-1,故D正确;
×0.10mol?L-1?min-1=0.15mol?L-1?min-1,故D正确;
故选C.
点评:本题考查化学平衡的计算、化学反应速率、平衡常数等,题目难度中等,注意掌握三段式法解题法.
 计算v(D),利用速率之比等于化学计量数之比计算x的值;
计算v(D),利用速率之比等于化学计量数之比计算x的值;B.根据D的物质的量利用方程式计算参加反应的B的物质的量,再根据转化率定义计算;
C.利用三段式计算平衡时各组分的平衡浓度,代入平衡常数表达式计算;
D.利用速率之比等于化学计量数之比计算v(A).
解答:解:A.5min后达到平衡生成1mol D,则v(D)=
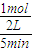 =0.10mol?L-1?min-1,速率之比等于化学计量数之比,故x:2=0.1:0.1,解得x=2,故A正确;
=0.10mol?L-1?min-1,速率之比等于化学计量数之比,故x:2=0.1:0.1,解得x=2,故A正确;B.5min后达到平衡生成1mol D,由方程式可知参加反应的B为1mol×
 =0.5mol,故B的转化率为
=0.5mol,故B的转化率为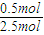 ×100%=20%,故B正确;
×100%=20%,故B正确;C.5min后达到平衡生成1mol D,D的平衡浓度为0.5mol/L,则:
3A(气)+B(气)?2C(气)+2D(气),
开始(mol/L):1.5 1.25 0 0
变化(mol/L):0.75 0.25 0.5 0.5
平衡(mol/L):0.75 1 0.5 0.5
故该温度平衡常数k=
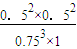 =
=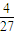 ,故C错误;
,故C错误;D.速率之比等于化学计量数之比,故v(A)=
 v(C)=
v(C)= ×0.10mol?L-1?min-1=0.15mol?L-1?min-1,故D正确;
×0.10mol?L-1?min-1=0.15mol?L-1?min-1,故D正确;故选C.
点评:本题考查化学平衡的计算、化学反应速率、平衡常数等,题目难度中等,注意掌握三段式法解题法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 把1 mol CO2和3mol H2通入1 L的密闭容器中,在某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
把1 mol CO2和3mol H2通入1 L的密闭容器中,在某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1测得CO2和CH3OH的浓度随时间变化如图所示,下列说法正确的是( )
| A、3min时,v正=v逆 | B、0~10 min内,氢气的平均反应速率为0.225 mol?L-1?min-1 | C、该温度下,反应的平衡常数K=5.3 mol-2?L2 | D、若升高温度,CO2的平衡转化率大于75% |
 此条件下,该反应达到化学平衡时,氮气的浓度为
此条件下,该反应达到化学平衡时,氮气的浓度为