题目内容
12.有机玻璃是一种重要的塑料,有机玻璃的单体A(C5H8O2)不溶于水,并可以发生以下变化: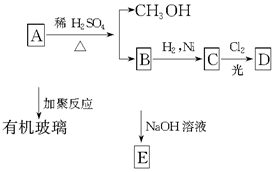
B结构简式为
 请回答:
请回答:(1)B分子中含有的官能团是碳碳双键、羧基.
(2)由B转化为C的反应属于②③(选填序号).
①氧化反应 ②还原反应 ③加成反应 ④取代反应
(3)C的结构简式是CH3CH(CH3)COOH.
(4)有机玻璃的结构简式是
 .
.(5)B使溴水褪色的化学方程式是
 +Br2→CH2BrC(CH3)BrCOOH
+Br2→CH2BrC(CH3)BrCOOH(6)由A生成B的化学方程式是CH2=C(CH3)COOCH3+H2O$?_{△}^{浓H_{2}SO_{4}}$CH2=C(CH3)COOH+CH3OH.
分析 由图中信息A能发生加聚反应,说明其中含有碳碳双键;同时A又能水解生成甲醇,说明A属于酯,B属于羧酸,则B中含有-COOH;又知A水解过程中破坏的只是酯基,而碳碳双键不变,B中含有C=C双键,B能与氢气发生加成反应也说明B含有C=C双键,符合B结构简式为  ,B转化成C的过程中没有碳原子的变化,即C中也只有4个碳原子,加成生成C的结构简式为CH3CH(CH3)COOH,B与NaOH反应生成E为CH2=C(CH3)COONa,C与氯气光照下发生取代反应生成D为CH3CCl(CH3)COOH或CH2ClCH(CH3)COOH,综上所述A为CH2=C(CH3)COOCH3,A加聚反应生成有机玻璃,有机玻璃的结构简式为
,B转化成C的过程中没有碳原子的变化,即C中也只有4个碳原子,加成生成C的结构简式为CH3CH(CH3)COOH,B与NaOH反应生成E为CH2=C(CH3)COONa,C与氯气光照下发生取代反应生成D为CH3CCl(CH3)COOH或CH2ClCH(CH3)COOH,综上所述A为CH2=C(CH3)COOCH3,A加聚反应生成有机玻璃,有机玻璃的结构简式为 ,以此来解答.
,以此来解答.
解答 解:(1)B为 ,分子中含有的官能团是碳碳双键、羧基,
,分子中含有的官能团是碳碳双键、羧基,
故答案为:碳碳双键;羧基;
(2)由B转化为C的反应,为碳碳双键与氢气的加成反应,也属于还原反应,则选②③,
故答案为:②③;
(3)C的结构简式是CH3CH(CH3)COOH,故答案为:CH3CH(CH3)COOH;
(4)有机玻璃的结构简式是 ,故答案为:
,故答案为: ;
;
(5)B使溴水褪色的化学方程式是 +Br2→CH2BrC(CH3)BrCOOH,
+Br2→CH2BrC(CH3)BrCOOH,
故答案为: +Br2→CH2BrC(CH3)BrCOOH;
+Br2→CH2BrC(CH3)BrCOOH;
(6)CH2=C(CH3)COOCH3在浓硫酸、加热条件下水解生成甲醇与CH2=C(CH3)COOH,则由A生成B的化学方程式是CH2=C(CH3)COOCH3+H2O$?_{△}^{浓H_{2}SO_{4}}$CH2=C(CH3)COOH+CH3OH,
故答案为:CH2=C(CH3)COOCH3+H2O$?_{△}^{浓H_{2}SO_{4}}$CH2=C(CH3)COOH+CH3OH.
点评 本题考查有机物的推断,为高频考点,把握图中转化、官能团与性质、有机反应为解答本题关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案| A. | SiO2$\stackrel{HCI(ap)}{→}$SiCl4$→_{高温}^{H_{2}}$Si | |
| B. | FeS2$→_{煅烧}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH3$\stackrel{HCI(ap)}{→}$NH4Cl(aq) | |
| D. | Al2O3$\stackrel{HCI(ap)}{→}$AlCl3(aq) $\stackrel{电解}{→}$ Al |
| A. | Na+、Al3+、Cl-、OH- (5:1:4:4) | B. | NH4+、Ba2+、OH-、Cl-(1:1:1:2) | ||
| C. | Ag+、NH4+、OH-、NO3-(1:3:3:1) | D. | K+、H+、I-、HCO3-(2:1:2:1) |
| A. | Fe2O3固体中混有A12O3:加入足量的盐酸,过滤 | |
| B. | SO2气体中混有HC1:通过饱和亚硫酸氢钠溶液 | |
| C. | FeCl2溶液中混有FeCl3:加入过量的铁粉,过滤 | |
| D. | KNO3固体中混有少量的NaCl:热水溶解、降温结晶、过滤 |

| A. | 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 | |
| B. | 实验仪器D可以起到防止溶液倒吸的作用 | |
| C. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 | |
| D. | 若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中无明显现象 |
 (“-→”表示反应一步完成)关系转化的是( )
(“-→”表示反应一步完成)关系转化的是( )| 选项 | a | b | c |
| A | Al2O3 | NaAlO2 | Al(OH)3 |
| B | AlCl3 | Al(OH)3 | NaAlO2 |
| C | Al | Al(OH)3 | Al2O3 |
| D | MgCl2 | Mg(OH)2 | MgO |
| A. | A | B. | B | C. | C | D. | D |
 可知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,如图中曲线b代表一定条件下该反应的进程.若使曲线b变为曲线a,可采取的措施是( )
可知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,如图中曲线b代表一定条件下该反应的进程.若使曲线b变为曲线a,可采取的措施是( )①增大A的浓度;②缩小容器的容积;③增大B的浓度;④升高温度;⑤加入合适的催化剂.
| A. | ⑤ | B. | ②④ | C. | ②⑤ | D. | ②③ |
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,再用待测溶液润洗后,注入待测溶液,然后调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗后,向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
③用蒸馏水将锥形瓶洗净后,从碱式滴定管中放入20.00mL待测溶液,滴入甲基橙作指示剂,然后用标准盐酸进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL;
④重复以上过程,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)锥形瓶中溶液的颜色从黄色变为橙色时,停止滴定.
(2)图1中,第②步“调节滴定管的尖嘴部分充满溶液”方法正确的是②,如果滴定前有气泡,滴定后气泡消失,由此对测定结果形成的影响是偏高(填“偏高”、“偏低”或“无影响”)
(3)图2中是某次滴定时的滴定管中的液面,其读数为23.60mL.
(4)根据下列数据:
| 滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 24.10 |
| 第二次 | 20.00 | 3.00 | 27.10 |
