题目内容
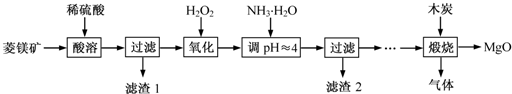
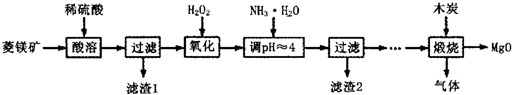
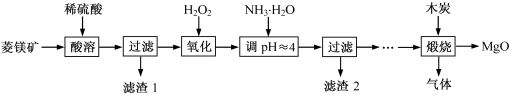
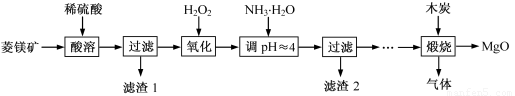
氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
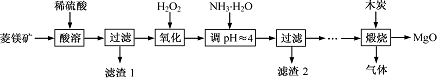
(1)MgCO3与稀硫酸反应的离子方程式为________.
(2)加入H2O2氧化时,发生反应的化学方程式为________.
(3)滤渣2的成分是________(填化学式).
(4)煅烧过程存在以下反应:
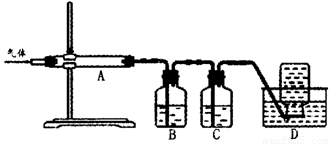
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C![]() MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
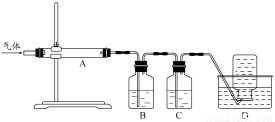
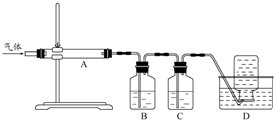
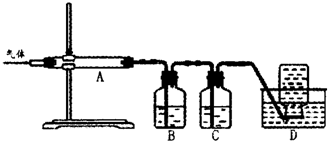
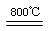
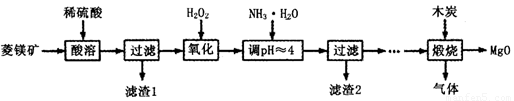
利用下图装置对煅烧产生的气体进行分步吸收或收集.
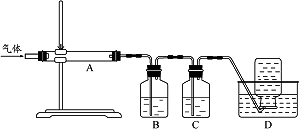
①D中收集的气体可以是________(填化学式).
②B中盛放的溶液可以是________(填字母).
a.NaOH溶液
b.Na2CO3溶液
c.稀硝酸
d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:________.
答案:

练习册系列答案
相关题目
 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑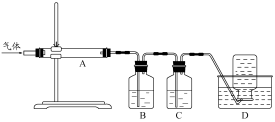

 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑