题目内容
在容积不变的密闭容器中,一定条件下发生反应:2A 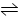 B(g)+ 2C(g),且达到平衡。当升高温度时,气体的密度增大,则下列叙述中正确的是( )
B(g)+ 2C(g),且达到平衡。当升高温度时,气体的密度增大,则下列叙述中正确的是( )
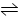 B(g)+ 2C(g),且达到平衡。当升高温度时,气体的密度增大,则下列叙述中正确的是( )
B(g)+ 2C(g),且达到平衡。当升高温度时,气体的密度增大,则下列叙述中正确的是( )| A.升高温度,正反应速率增大,逆反应速率减小 |
| B.若正反应是放热反应,则A为气态 |
| C.物质A一定为非气态,且正反应是吸热反应 |
| D.若向容器中充入惰性气体,则平衡向右移动 |
C
升高温度气体的密度增大,由于容器的容积不变所以气体的总体积不发生变化,要使密度增大则气体的质量增大,B和C都是气体那么A是非气体,升高温度正逆反应速率都增大,所以A和B都错误;升高温度平衡气体密度增大,说明平衡向正反应方向移动,所以正反应方向是吸热的方向,C正确;向容器中充入惰性气体,由于容器的体积不发生变化各物质的浓度不发生变化,平衡不发生移动,D错误;所以答案选C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
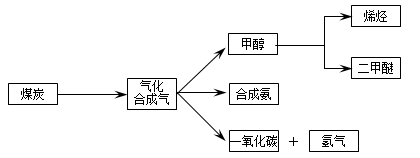
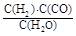 ,它所对应反应的化学方程式为 。
,它所对应反应的化学方程式为 。 温度230~280℃)进行下列反应:
温度230~280℃)进行下列反应: CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1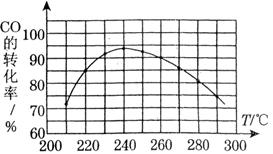
 。
。
 2SO3(g),在已达到平衡后的反应容器中充入少量18O2,一段时间后18O存在于:
2SO3(g),在已达到平衡后的反应容器中充入少量18O2,一段时间后18O存在于: H2(g)+I2(g)达到平衡后,下列说法中,正确的是:
H2(g)+I2(g)达到平衡后,下列说法中,正确的是:
 ,温度分别为T1和T2时,X的转化率
,温度分别为T1和T2时,X的转化率 随时间变化的关系如右图所示。则下列结论正确的是
随时间变化的关系如右图所示。则下列结论正确的是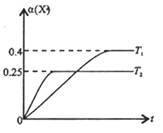
 均减小,Y的转化率
均减小,Y的转化率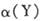 也减小
也减小
 2C(g);ΔH<0。达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
2C(g);ΔH<0。达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是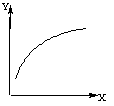
 4NO2(g)+ O2(g);△H >0,T1温度下的部分实验数据如下表.下列说法不正确的是
4NO2(g)+ O2(g);△H >0,T1温度下的部分实验数据如下表.下列说法不正确的是  N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。
N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。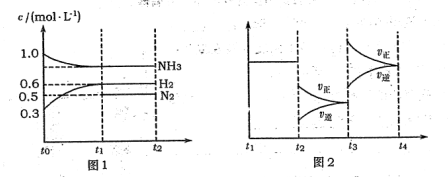
 体密度不再发生变化
体密度不再发生变化