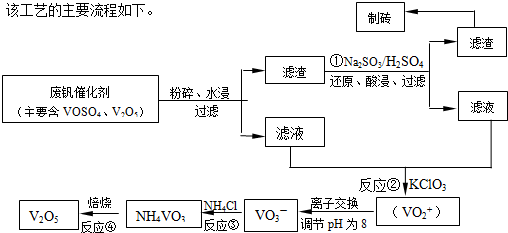
题目内容
 (2012?焦作一模)某同学在三个容积相同的密闭容器中,研究三种不同条件下化学反应2X(g)?Y(g)+W(g)的进行情况,其中实验Ⅰ、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0mol?L-1,c(Y)=c(W)=0,测得反应物X的浓度随时间的变化如图所示,下列说法不正确的是( )
(2012?焦作一模)某同学在三个容积相同的密闭容器中,研究三种不同条件下化学反应2X(g)?Y(g)+W(g)的进行情况,其中实验Ⅰ、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0mol?L-1,c(Y)=c(W)=0,测得反应物X的浓度随时间的变化如图所示,下列说法不正确的是( )分析:A、由图可知,实验Ⅰ到达平衡的时间短,平衡时实验Ⅰ与实验Ⅱ中X的浓度不变,说明不影响平衡移动,该反应前后气体的物质的量不变,故可能为增大压强或使用催化剂;
B、温度越高反应速率越快,到达平衡的时间越短,故温度T1<T2,温度越高,平衡时X的浓度越小,说明升高温度平衡向正反应方向移动,据此判断;
C、由图可知,实验Ⅲ平衡时X的浓度小,X的物质的量小,该反应前后气体的物质的量不变,实验Ⅲ平衡时X的体积百分含量低;
D、浓度降低,压强减小,该反应前后气体的物质的量不变,变化不移动,X的转化率不变,由图可知,实验Ⅰ到达平衡时X的浓度为0.5mol/L,故X的浓度变化量为1mol/L-0.5mol/L=0.5mol/L,计算X转化率,据此计算.
B、温度越高反应速率越快,到达平衡的时间越短,故温度T1<T2,温度越高,平衡时X的浓度越小,说明升高温度平衡向正反应方向移动,据此判断;
C、由图可知,实验Ⅲ平衡时X的浓度小,X的物质的量小,该反应前后气体的物质的量不变,实验Ⅲ平衡时X的体积百分含量低;
D、浓度降低,压强减小,该反应前后气体的物质的量不变,变化不移动,X的转化率不变,由图可知,实验Ⅰ到达平衡时X的浓度为0.5mol/L,故X的浓度变化量为1mol/L-0.5mol/L=0.5mol/L,计算X转化率,据此计算.
解答:解:A、由图可知,实验Ⅰ到达平衡的时间短,平衡时实验Ⅰ与实验Ⅱ中X的浓度不变,说明不影响平衡移动,该反应前后气体的物质的量不变,故可能为增大压强或使用催化剂,故A正确;
B、温度越高反应速率越快,到达平衡的时间越短,故温度T1<T2,温度越高,平衡时X的浓度越小,说明升高温度平衡向正反应方向移动,故正反应是吸热反应,故B正确;
C、由图可知,实验I、II衡时X的浓度相等,实验Ⅲ平衡时X的浓度小,X的物质的量小,该反应前后气体的物质的量不变,实验Ⅲ平衡时X的体积百分含量比实验I、II低,故C错误;
D、由图可知,实验Ⅰ到达平衡时X的浓度为0.5mol/L,故X的浓度变化量为1mol/L-0.5mol/L=0.5mol/L,X转化率为
×100%=50%,起始浓度c(X)=0.8mol?L-1,浓度降低,压强减小,该反应前后气体的物质的量不变,变化不移动,X的转化率不变,则平衡浓度c(X)=0.8mol?L-1×50%=0.4mol?L-1,故D正确;
故选C.
B、温度越高反应速率越快,到达平衡的时间越短,故温度T1<T2,温度越高,平衡时X的浓度越小,说明升高温度平衡向正反应方向移动,故正反应是吸热反应,故B正确;
C、由图可知,实验I、II衡时X的浓度相等,实验Ⅲ平衡时X的浓度小,X的物质的量小,该反应前后气体的物质的量不变,实验Ⅲ平衡时X的体积百分含量比实验I、II低,故C错误;
D、由图可知,实验Ⅰ到达平衡时X的浓度为0.5mol/L,故X的浓度变化量为1mol/L-0.5mol/L=0.5mol/L,X转化率为
| 0.5mol/L |
| 1mol/L |
故选C.
点评:考查物质的量浓度随时间变化图象、影响化学平衡的因素、化学平衡的有关计算,难度中等,注意该反应前后气体的物质的量不变,压强不影响平衡移动.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目


 +2NaOH
+2NaOH
 +HCOONa+H2O
+HCOONa+H2O
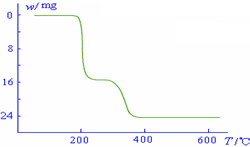 化的曲线如右图所示.则NH4VO3在分解过程中
化的曲线如右图所示.则NH4VO3在分解过程中