��Ŀ����
����Ŀ��(1)�����Ͻ����κ��Է���������ԭ��Ӧ��������Ƴ�ԭ��أ������������з�Ӧ��Cu + 2Ag+ = 2Ag + Cu2+������һ����ѧ��أ�
�ٻ���������ԭ���װ��ͼ_____________________________ (�������������缫���Ϻ͵������Һ)
����������_____(����������������������������������ͬ)����������______
(2)����ȼ�ϵ�صĹ���ԭ����ͼ��ʾ��

�ٸõ�ع���ʱ��b��ͨ�������Ϊ______��c��ͨ�������Ϊ______��
�ڸõ�ظ����ĵ缫��ӦʽΪ��_____________________________��
�۹���һ��ʱ���3.2g������ȫ��Ӧ����CO2ʱ����_______������ת�ƣ�
���𰸡�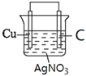 ���� ���� CH4 O2(����) CH4 - 8e- + 2H2O = CO2 + 8H+ 1.6NA
���� ���� CH4 O2(����) CH4 - 8e- + 2H2O = CO2 + 8H+ 1.6NA
��������
(1)���ݷ�Ӧ����ʽ֪��Cuʧ���ӣ����������������Һ�к��еõ��ӵ�Ag+��������������Һ���������Һ����������C���ݴ����ʵ��װ��ͼ�������ԭ���ԭ���������
(2)�ٸ����������ƶ�����֪���Ҳ�缫Ϊ���������缫Ϊ������
�ڸ�����ȼ��ʧ���ӷ���������Ӧ���������������õ��ӷ�����ԭ��Ӧ��
�۸��ݼ����ת�Ƶ���֮��Ĺ�ϵʽ���㡣
(1)��ԭ�����ʧ���ӵ����������������ݷ�Ӧ����ʽCu + 2Ag+ = 2Ag + Cu2+֪��Cu���������������Һ�к��еõ��ӵ�Ag+��������������Һ���������Һ����������C��������������Ϊ��������������װ��ͼΪ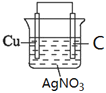 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
�ڸõ�ع���ʱ��������Ag+�õ������ɽ��������������ӣ�������ͭʧȥ���ӱ��ͭ���ӣ�������С���ʴ�Ϊ�����ӣ����٣�
(2)�ٸ��������ӵ��ƶ�����֪���Ҳ�缫Ϊ�����������������õ��ӣ����缫Ϊ������������ͨ��ȼ�ϼ��飬�ʴ�Ϊ��CH4��O2��
�ڸ����ϼ���ʧ���Ӻ�ˮ��Ӧ���ɶ�����̼�������ӣ��缫��ӦʽΪCH4 - 8e- + 2H2O = CO2 + 8H+���ʴ�Ϊ��CH4 - 8e- + 2H2O = CO2 + 8H+��
��3.2g��������ʵ���=![]() =0.2mol������CH4 - 8e- + 2H2O = CO2 + 8H+֪�� 3.2g������ȫ��Ӧ����CO2ʱ��ת�Ƶ��ӵ����ʵ���=0.2mol��8=1.6mol����ת�Ƶ��Ӹ���Ϊ1.6NA���ʴ�Ϊ��1.6NA��
=0.2mol������CH4 - 8e- + 2H2O = CO2 + 8H+֪�� 3.2g������ȫ��Ӧ����CO2ʱ��ת�Ƶ��ӵ����ʵ���=0.2mol��8=1.6mol����ת�Ƶ��Ӹ���Ϊ1.6NA���ʴ�Ϊ��1.6NA��

 ���100��1�ž�ϵ�д�
���100��1�ž�ϵ�д�����Ŀ������ʵ���У���Ӧ�������Լ����۶���ȷ�����߾��������ϵ����
ѡ�� | ʵ�� | ���� | ���� |
A | ����ɫֽ�����뵽������ˮ�� | ֽ����ɫ | ������Ư���� |
B | �������ữ��H2O2��Һ���뵽Fe(NO3)2��Һ�� | ��Һ���ɫ | H2O2�����Ա�Fe3+ǿ |
C | ������ǯ��סһС����ɰֽ��ϸ��ĥ���������ھƾ����ϼ��� | ���ۻ��ҵ������� | �����۵�ϵ� |
D | ��NaI��Һ���뵽AgCl����Һ�� | ������ɫ���� | Ksp(AgCl)>Ksp(AgI) |
A. AB. BC. CD. D