题目内容
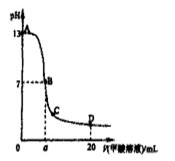
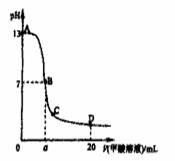
向15mL 0.1mol/L Ba(OH)2溶液中,滴加等浓度NH4Al(SO4)2溶液x mL,叙述错误的是?( )
分析:单独发生反应Ba2++SO42-=BaSO4↓.其它离子反应,首先Al3++3OH-=Al(OH)3↓;然后发生NH4++OH-=NH3?H2O,最后发生Al(OH)3+OH-=AlO2-+H2O,根据n=cV计算Ba(OH)2、NH4Al(SO4)2的物质的量,进而计算各离子的物质的量,根据离子反应的先后顺序进行过量计算判断,结合水解及离子的物质的量判断.
解答:解:15mL 0.1mol/L Ba(OH)2溶液中氢氧化钡的物质的量为0.0015mol,n(Ba2+)=0.0015mol,n(OH-)=0.003mol;
A.当x=5时,NH4Al(SO4)2的物质的量为0.0005mol,n(SO42-)=0.001mol,n(Al3+)=0.0005mol,n(NH4+)=0.0005mol.SO42-与Ba2+反应,SO42-不足,Ba2+剩余0.0005mol;0.0005molAl3+反应生成Al(OH)3消耗OH-的量为0.0015mol,溶液中没有Al3+,生成0.0005molAl(OH)3,还剩余0.0015molOH-;然后0.0005molNH4+反应消耗OH-的量为0.0005mol,溶液中NH4+完全反应,剩余0.001molOH-;0.0005molAl(OH)3又完全溶解,生成0.0005molAlO2-,消耗0.0005molOH-,最终剩余0.0005molOH-.溶液中AlO2-水解,故OH->AlO2-,综上所述,溶液中有Ba2+、OH-、AlO2-,且OH->AlO2-,故A正确;
B.当x=7.5时,NH4Al(SO4)2的物质的量为0.00075mol,n(SO42-)=0.0015mol,n(Al3+)=0.00075mol,n(NH4+)=0.00075mol.SO42-与Ba2+恰好反应,Ba2+没有剩余;0.00075molAl3+反应生成Al(OH)3消耗OH-的量为0.00225mol,溶液中没有Al3+,生成0.0005molAl(OH)3,还剩余0.00075molOH-;然后0.00075molNH4+恰好反应,溶液为氨水,故B错误;
C.当x=10时,NH4Al(SO4)2的物质的量为0.001mol,n(SO42-)=0.002mol,n(Al3+)=0.001mol,n(NH4+)=0.001mol.SO42-与Ba2+反应,Ba2+不足,SO42-剩余0.0005mol;0.001molAl3+反应生成Al(OH)3消耗OH-的量为0.003mol,溶液中没有Al3+,生成0.001molAl(OH)3,OH-完全反应,溶液中NH4+不反应,此时溶液为硫酸铵溶液,铵根离子水解,溶液呈酸性,综上所述,溶液中有SO42-、NH4+,且H+>OH-,故C正确;
D.当x=15时,NH4Al(SO4)2的物质的量为0.0015mol,n(SO42-)=0.003mol,n(Al3+)=0.0015mol,n(NH4+)=0.0015mol.SO42-与Ba2+反应,Ba2+不足,SO42-剩余0.0015mol;0.0015molAl3+反应生成Al(OH)3消耗OH-的量为0.0045mol,OH-不足,溶液中0.001molAl3+反应,生成0.001molAl(OH)3,溶液中剩余
0.0005molAl3+,溶液中NH4+不反应,此时溶液为硫酸铵、硫酸铝溶液,铵根离子、铝离子水解,溶液呈酸性,综上所述,溶液中有SO42-、NH4+、Al3+,且NH4+>Al3+,故D正确
故选B.
A.当x=5时,NH4Al(SO4)2的物质的量为0.0005mol,n(SO42-)=0.001mol,n(Al3+)=0.0005mol,n(NH4+)=0.0005mol.SO42-与Ba2+反应,SO42-不足,Ba2+剩余0.0005mol;0.0005molAl3+反应生成Al(OH)3消耗OH-的量为0.0015mol,溶液中没有Al3+,生成0.0005molAl(OH)3,还剩余0.0015molOH-;然后0.0005molNH4+反应消耗OH-的量为0.0005mol,溶液中NH4+完全反应,剩余0.001molOH-;0.0005molAl(OH)3又完全溶解,生成0.0005molAlO2-,消耗0.0005molOH-,最终剩余0.0005molOH-.溶液中AlO2-水解,故OH->AlO2-,综上所述,溶液中有Ba2+、OH-、AlO2-,且OH->AlO2-,故A正确;
B.当x=7.5时,NH4Al(SO4)2的物质的量为0.00075mol,n(SO42-)=0.0015mol,n(Al3+)=0.00075mol,n(NH4+)=0.00075mol.SO42-与Ba2+恰好反应,Ba2+没有剩余;0.00075molAl3+反应生成Al(OH)3消耗OH-的量为0.00225mol,溶液中没有Al3+,生成0.0005molAl(OH)3,还剩余0.00075molOH-;然后0.00075molNH4+恰好反应,溶液为氨水,故B错误;
C.当x=10时,NH4Al(SO4)2的物质的量为0.001mol,n(SO42-)=0.002mol,n(Al3+)=0.001mol,n(NH4+)=0.001mol.SO42-与Ba2+反应,Ba2+不足,SO42-剩余0.0005mol;0.001molAl3+反应生成Al(OH)3消耗OH-的量为0.003mol,溶液中没有Al3+,生成0.001molAl(OH)3,OH-完全反应,溶液中NH4+不反应,此时溶液为硫酸铵溶液,铵根离子水解,溶液呈酸性,综上所述,溶液中有SO42-、NH4+,且H+>OH-,故C正确;
D.当x=15时,NH4Al(SO4)2的物质的量为0.0015mol,n(SO42-)=0.003mol,n(Al3+)=0.0015mol,n(NH4+)=0.0015mol.SO42-与Ba2+反应,Ba2+不足,SO42-剩余0.0015mol;0.0015molAl3+反应生成Al(OH)3消耗OH-的量为0.0045mol,OH-不足,溶液中0.001molAl3+反应,生成0.001molAl(OH)3,溶液中剩余
0.0005molAl3+,溶液中NH4+不反应,此时溶液为硫酸铵、硫酸铝溶液,铵根离子、铝离子水解,溶液呈酸性,综上所述,溶液中有SO42-、NH4+、Al3+,且NH4+>Al3+,故D正确
故选B.
点评:本题考查离子方程式的有关计算、过量计算等,题目涉及离子反应较多,且有先后顺序,反应复杂,计算量较大,为易错题目,难度较大,清楚氢氧根离子与铵根离子、铝离子反应的先后顺序是解题的关键.本题采取过程法解答,利用学生理解反应进行的过程.

练习册系列答案
相关题目