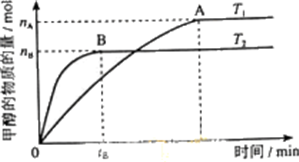
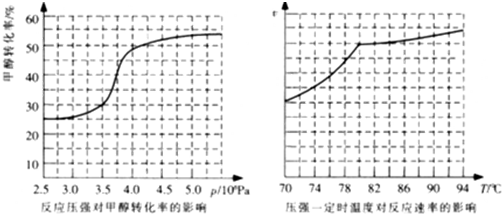
题目内容
已知H2(g)和CO(g)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol。
则一氧化碳与液态水反应,生成二氧化碳和氢气的热化学方程式为
________________________________________________________;
【答案】
CO(g)+H2O(l)=CO2(g)+H2(g) ΔH=+2.8 /mol(2分)
【解析】
试题分析:由H2(g)和CO(g)的燃烧热△H分别为-285.8kJ·mol-1、kJ·mol,可知二者燃烧的方程式分别为:H2(g)+1/2O2(g)=H20(l) ΔH=-285.8 kJ /mol ①;CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ /mol ②,由②-①珂得CO(g)+H2O(l)=CO2(g)+H2(g) ΔH=+2.8 /mol
考点:考查反应热及其盖斯定律、热化学方程式书写等相关知识。

练习册系列答案
相关题目
 碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.
碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.