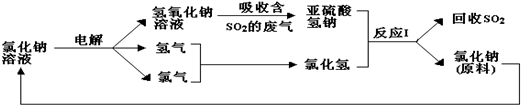
题目内容
15.由碳和氧两种元素组成的气体中,碳与氧的质量之比为3:5,则该气体可能是( )| A. | 由CO或CO2单独组成的纯净物 | B. | 由CO和CO2共同组成的混合物 | ||
| C. | 由CO2和O2共同组成的混合物 | D. | 由CO、CO2和O2共同组成的混合物 |
分析 根据由碳、氧两种元素组成的气体有CO、CO2和O2,其中CO、CO2中碳与氧的质量比分别是12:16=3:4和12:(16×2)=3:8,所以不可能是某一种物质,也不可能是二氧化碳与氧气的混合物,因为那会使碳、氧的质量比大于3:5.即混合物中必然是一个的比小于3:5,而另一个大于3:5;据此进行分析解答.
解答 解:由碳、氧两种元素组成的气体有CO、CO2和O2,其中CO、CO2中碳与氧的质量比分别是12:16=3:4和12:(16×2)=3:8,所以不可能是某一种物质,也不可能是二氧化碳与氧气的混合物,因为那会使碳、氧的质量比小于3:5.即混合物中必然是一个的比小于3:5,而另一个大于3:5;该混合物可能是CO、CO2的混合气体,CO、O2的混合气体,CO、O2和CO2的混合气体.
A、由上述分析,该气体一定是混合物,故选项错误;
B、由上述分析,该气体一定是混合物,不可能是纯净物,故选项正确;
C、该混合物可能是CO、CO2的混合气体,CO、O2的混合气体,CO、O2和CO2的混合气体,故选错误;
D、该混合物可能是CO、CO2的混合气体,CO、O2的混合气体,CO、O2和CO2的混合气体,故选项正确.
故选:BD.
点评 本题有一定难度,考查混合气体成分的确定,熟悉含C、O元素的气体、学会利用极限法和平均值法是解答本题的关键.

练习册系列答案
相关题目
5.下列说法中正确的是( )
| A. | 1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L | |
| B. | 从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol/L | |
| C. | 配制500 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾 | |
| D. | 中和100 mL 1 mol/L的H2SO4溶液,需NaOH 4 g |
3.下列物质中前者是混合物,后者是纯净物的是( )
| A. | 铜绿、氧化镁 | B. | 空气、石灰水 | C. | 矿泉水、水煤气 | D. | 海水、胆矾 |
10.机动车尾气排放的氮的氧化物,是城市空气污染源之一,其中一种含氮元素的质量分数为46.7%,它是( )
| A. | N2O | B. | NO2 | C. | NO | D. | N2O5 |
20.下列说法不正确的是( )
| A. | H2在Cl2中燃烧会产生苍白色火焰 | |
| B. | 氯水用于漂白表现了HClO的强氧化性 | |
| C. | 漂粉精是混合物,其有效成分是次氯酸钠 | |
| D. | 漂粉精放入稀酸中可以提高漂白速度 |
7.下列说法中正确的是( )
| A. | 3He原子中的质子在原子核外空间内一定轨道上绕核做高速运动 | |
| B. | 3He原子不是微小的实心球体 | |
| C. | 3He原子是不能再分的微粒 | |
| D. | 3He的最外层电子数为2,易与其他物质发生化学反应 |
4.若下列物质均为1mol,则含原子数最多的是( )
| A. | CO | B. | CH4 | C. | N2 | D. | NO |
5.表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
(1)上述元素的单质中熔点最高的可能是碳(填元素名称).
(2)D的氢化物比G的氢化物稳定,其原因是碳的非金属性比硅的强的缘故.
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为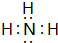 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程:
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程: .
.
(4)A、F、C构成的化合物含离子键和极性共价键,若将它溶于水中,离子键被破坏(填“离子键”、“极性共价键”“非极性共价键”).
| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |
(2)D的氢化物比G的氢化物稳定,其原因是碳的非金属性比硅的强的缘故.
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为
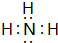 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程:
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).用电子式表示I与H形成的化合物的形成过程: .
.(4)A、F、C构成的化合物含离子键和极性共价键,若将它溶于水中,离子键被破坏(填“离子键”、“极性共价键”“非极性共价键”).