题目内容
(13分)(1)A、B、C、D四种元素处于同一周期;在同族元素中,A的气态氢化物的沸点最高;B的最高价氧化物对应的水化物的酸性在同周期中是最强的;C的电负性介于A、B之间,D与B相邻。
① A、B、C三种元素原子的第一电离能由大到小的顺序是(写元素符号)_____________ ;
② B的单质分子中存在_____________个π键;
③ D和B形成一种超硬、耐磨、耐高温的新型化合物,其熔点比金刚石_____________ (填“高”或“低”);
(2)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,但却是强温室气体,下列推测不正确的是
A.NF3分子呈三角锥形
B.C3F8在CCl4中的溶解度比在水中
C.CHClFCF3存在手性异构
(3) 氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应,写出铬原子的基态的核外电子排布式_____________________。某含Ti3+的配合物,化学式为[TiCl(H2O)5]Cl2?H2O。该配合物的配体是_____________。
(1) ① FNO (2分) ② 2 (2分) ③高(2分)
(2)B. (2分)
(3) 1S22S22P63S23P63d54s1 (3分) Cl- H2O(2分)

练习册系列答案
相关题目

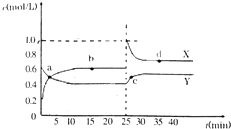 已知:2NO2(g)?N2O4(g)△H<O.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
已知:2NO2(g)?N2O4(g)△H<O.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示. 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)