题目内容
下列说法正确的是( )
A.原子序数越大,原子半径一定越大
B.电子层数越多的原子半径一定比电子层数少的原子半径大
C.元素性质的周期性变化不是元素性质的简单重复
D.按C、N、O、F的顺序,元素的最高正化合价依次升高
C
解析

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
镓是1871年俄国化学家门捷列夫在编制元素周期表时曾预言的“类铝”元素。镓的原子序数为31,属ⅢA族。镓的熔点为29.78 ℃,沸点高达2 403 ℃。镓有过冷现象(即冷至熔点下不凝固),它可过冷到-120 ℃。由此判断下列有关镓的性质及其用途的叙述不正确的是( )。
| A.镓是制造高温温度计的上佳材料 |
| B.镓能溶于强酸和强碱中 |
| C.镓与锌、锡、铟等金属制成的合金,可用在自动救火的水龙头中 |
| D.近年来镓成为电子工业的新宠,其主要用途是制造半导体材料,被誉为“半导体家族的新成员”,这是利用了镓的导电性介于导体和绝缘体之间的性质 |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )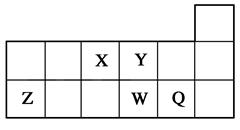
| A.元素X与元素Z的最高正化合价之和的数值等于8 |
| B.原子半径的大小顺序为:rX>rY>rZ>rW>rQ |
| C.离子Y2-和Z3+的核外电子数和电子层数都不相同 |
| D.元素W的最高价氧化物对应的水化物的酸性比Q的强 |
科学家根据元素周期律和原子结构理论预测,原子序数为114的元素位于第七周期第ⅣA族,称为类铅元素。下面关于它的原子结构和性质的预测正确的是( )
| A.类铅元素原子的最外层电子数为6 |
| B.其常见价态为+2、+3、+4 |
| C.它的金属性比铅强 |
| D.它的原子半径比铅小 |
根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
| A.K层电子数为奇数的所有元素所在族的序数与该元素原子的K层电子数相等 |
| B.L层电子数为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 |
| C.L层电子数为偶数的所有元素所在族的序数与该元素原子的L层电子数相等 |
| D.M层电子数为奇数的所有元素所在族的序数与该元素原子的M层电子数相等 |
下列说法肯定错误的是( )
| A.某原子K层上只有一个电子 |
| B.某原子M层上的电子数为L层上电子数的4倍 |
| C.某离子M层上和L层上的电子数均为K层的4倍 |
| D.某离子的核电荷数与最外层电子数相等 |
已知钡的活动性介于钠和钾之间,下列叙述正确的是( )
| A.钡与水反应不如钠与水反应剧烈 |
| B.钡可以从KCl溶液中置换出钾 |
| C.氧化性:K+>Ba2+>Na+ |
| D.碱性:KOH>Ba(OH)2>NaOH |
已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,其氢化物中甲、乙、丙、丁、戊的化合价如下,下列说法正确的是( )
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
A.乙的常见氧化物只有一种
B.气态氢化物稳定性:丙>丁
C.丙的氧化物能与戊的氢化物的水溶液反应
D.原子半径大小:戊<丙