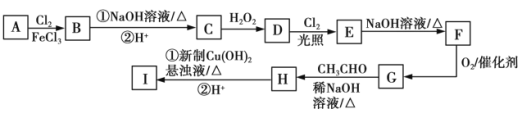
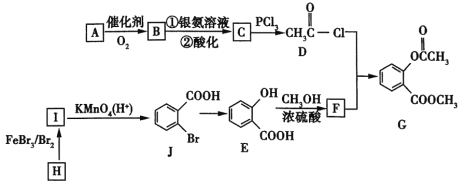
题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
B.反应 5NH4NO3![]() 2HNO3+4N2↑ +9H2O 中,生成 28 g N2 时,转移的电子数目为3.75 NA
2HNO3+4N2↑ +9H2O 中,生成 28 g N2 时,转移的电子数目为3.75 NA
C.0.1 mo1·L-1 MgCl2溶液中含Cl-数为0.2NA
D.3.9 g Na2O2 晶体中含有的离子总数为0.2NA
【答案】B
【解析】
A. 在氢氧化钠溶液中,氢氧根绝大多数来自氢氧化钠的电离,氢离子全部来自水的电离,而pH=13的NaOH溶液中,氢离子浓度为1013mol/L,故1L溶液中水电离出的氢离子的物质的量为1013mol,水电离出的氢氧根的物质的量也为1013mol,个数为1013NA,故A错误;
B.反应 5NH4NO3![]() 2HNO3+4N2↑ +9H2O 中,生成 28 g N2 时,转移的电子数目为3.75 mol ,故转移的电子数目为3.75 NA,故B正确;
2HNO3+4N2↑ +9H2O 中,生成 28 g N2 时,转移的电子数目为3.75 mol ,故转移的电子数目为3.75 NA,故B正确;
C. 溶液体积不明确,故溶液中的氯离子的个数无法计算,故C错误;
D.3.9g过氧化钠的物质的量为0.05mol,而过氧化钠中含2个钠离子和1个过氧根离子,故0.05mol过氧化钠中含有的离子个数为1.5NA个,故D错误。
答案选B。

【题目】CO2与CH4可制得合成气:CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH=+247 kJ·mol-1。初始温度均为T K时,在3个容器中按不同方式投入反应物,发生上述反应,相关信息如下表:
容器 | 起始物质的量/mol | CO2平衡转化率(α) | |||||
编号 | 容积/L | 条件 | CH4(g) | CO2(g) | CO(g) | H2(g) | |
Ⅰ | 2 | 恒温恒容 | 2 | 1 | 0 | 0 | 50% |
Ⅱ | 1 | 0.5 | 1 | 0 | 0 | ||
Ⅲ | 1 | 绝热恒容 | 1 | 0.5 | 0 | 0 | - |
下列说法正确的是
A.T K时,反应CH4(g)+CO2(g)2CO(g)+2H2(g)的平衡常数为1/3
B.容器Ⅱ中反应达到平衡时,α(CO2,Ⅱ)=50%
C.容器Ⅲ中反应达到平衡时反应热在123.5—247 kJ·mol-1范围内
D.容器Ⅱ中反应达到平衡时,再投入0.5 mol CH4、0.25 mol CO,反应达到新平衡前,v(正)<v(逆)
【题目】某学习小组利用二氧化氯![]() 制备消毒剂、漂白剂亚氯酸钠
制备消毒剂、漂白剂亚氯酸钠![]() ,有关反应原理:
,有关反应原理:![]() 放热反应
放热反应![]()
实验一、制备![]() 晶体
晶体
选择如图所示装置设计实验制备亚氯酸钠晶体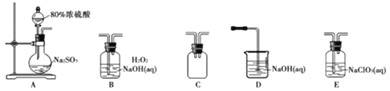
已知:饱和![]() 溶液析出晶体与度关系如下表所示:
溶液析出晶体与度关系如下表所示:
温度 |
|
|
|
品体成分 |
|
|
|
⑴装置连接顺序:![]() ______
______
⑵C装置的作用是______D装置作用是______
⑶A装置中选择![]() 浓硫酸的理由是______
浓硫酸的理由是______
⑷写出E装置中发生反应的离子方程式______
⑸对B装置中溶液采用结晶法提取无水亚氯酸钠晶体,操作分别为蒸发结晶、趁热过滤、用![]() 左右热水洗涤、低于
左右热水洗涤、低于![]() 条件下干燥,得到成品,蒸发结晶时控制温度为______
条件下干燥,得到成品,蒸发结晶时控制温度为______
实验二、测定产品纯度
⑹准确称量/span>ag产品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应:![]() ,将所得混合溶液稀释成250mL待测液。取
,将所得混合溶液稀释成250mL待测液。取![]() 待测液于锥形瓶,加入淀粉溶液作指示剂,用
待测液于锥形瓶,加入淀粉溶液作指示剂,用![]() 标准
标准![]() 溶液滴定至终点,测得消耗
溶液滴定至终点,测得消耗![]() 标准溶液的体积为
标准溶液的体积为![]() (已知:
(已知:![]() )
)
![]() 该产品纯度为______(只要求列出计算式)
该产品纯度为______(只要求列出计算式)
![]() 若滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失,则测得结果______(填“偏高偏低”或“无影响”)
若滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失,则测得结果______(填“偏高偏低”或“无影响”)