题目内容
实验室常用的浓盐酸物质的量浓度约为12.0mol?L-1.
(1)实验室欲用上述浓盐酸配制480mL 0.20mol?L-1 的稀盐酸溶液,则需要取上述浓盐酸
(2)配制过程中,不需要的仪器(填写代号)
A.药匙 B.胶头滴管 C.玻璃棒 D.烧杯
完成实验还缺少的仪器是
(3)取用任意体积的所配0.20mol?L-1 HCl溶液时,下列物理量中不随所取体积的多少而变化的是
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(4)用15.8g KMnO4氧化足量的上述浓盐酸.反应方程式如下:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
则:①有多少摩尔HCl被氧化?
②产生的Cl2在标准状况下的体积为多少?
(1)实验室欲用上述浓盐酸配制480mL 0.20mol?L-1 的稀盐酸溶液,则需要取上述浓盐酸
8.3
8.3
mL.(2)配制过程中,不需要的仪器(填写代号)
A
A
.A.药匙 B.胶头滴管 C.玻璃棒 D.烧杯
完成实验还缺少的仪器是
10mL量筒、500mL容量瓶
10mL量筒、500mL容量瓶
.(3)取用任意体积的所配0.20mol?L-1 HCl溶液时,下列物理量中不随所取体积的多少而变化的是
BD
BD
(填字母)A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(4)用15.8g KMnO4氧化足量的上述浓盐酸.反应方程式如下:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
则:①有多少摩尔HCl被氧化?
②产生的Cl2在标准状况下的体积为多少?
分析:(1)根据溶液稀释前后溶质的物质的量不变计算所需盐酸的体积;
(2)根据溶液的配制步骤选择所使用的仪器;
(3)根据溶液为均一稳定化合物的特征分析;
(4)①根据Cl元素化合价的变化可知,16molHCl参加反应时,有10molHCl被氧化,然后根据反应的化学方程式计算;
②根据V=nVm来计算.
(2)根据溶液的配制步骤选择所使用的仪器;
(3)根据溶液为均一稳定化合物的特征分析;
(4)①根据Cl元素化合价的变化可知,16molHCl参加反应时,有10molHCl被氧化,然后根据反应的化学方程式计算;
②根据V=nVm来计算.
解答:解:(1)没有480mL容量瓶,所以选择500mL容量瓶,设需要浓盐酸的体积为V,0.2mol/L×0.5L=12mol/L×V,V=0.083L=8.3mL,故答案为:8.3;
(2)操作步骤有计算、量取、溶解、移液、洗涤移液、定容、摇匀等操作,一般用10mL量筒浓盐酸,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,所以所需仪器有10mL量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,故答案为:A;10mL量筒、500mL容量瓶;
(3)溶液为均一稳定化合物,取用任意体积的该盐酸溶液时,溶液的浓度和密度不变,而体积不同,则溶液的质量和物质的量不同,故答案为:BD;
(4)n(KMnO4)=
=0.1mol,
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 被氧化的HCl
2mol 5mol 10mol
0.1mol n(Cl2) n(HCl)被氧化
则n(HCl)被氧化=0.5mol,n(Cl2)=0.25mol,
所以Cl2的体积V=nVm=0.25mol×22.4L/mol=5.6L,
答:①有0.5molHCl被氧化;②产生的Cl2在标准状况下的体积为5.6L.
(2)操作步骤有计算、量取、溶解、移液、洗涤移液、定容、摇匀等操作,一般用10mL量筒浓盐酸,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,所以所需仪器有10mL量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,故答案为:A;10mL量筒、500mL容量瓶;
(3)溶液为均一稳定化合物,取用任意体积的该盐酸溶液时,溶液的浓度和密度不变,而体积不同,则溶液的质量和物质的量不同,故答案为:BD;
(4)n(KMnO4)=
| 15.8g |
| 158g/mol |
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 被氧化的HCl
2mol 5mol 10mol
0.1mol n(Cl2) n(HCl)被氧化
则n(HCl)被氧化=0.5mol,n(Cl2)=0.25mol,
所以Cl2的体积V=nVm=0.25mol×22.4L/mol=5.6L,
答:①有0.5molHCl被氧化;②产生的Cl2在标准状况下的体积为5.6L.
点评:本题一定物质的量浓度溶液的配制、化学方程式的计算,题目难度中等,注意有关反应的化学方程式以及物质的量的相关计算公式的运用.

练习册系列答案
相关题目
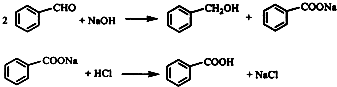






 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
