题目内容
【题目】在反应2Al+6HCl=2AlCl3+3H2中:
(1)该反应被氧化的元素是______,被还原的元素是_______(填元素符号)。
(2)该反应中氧化剂是________,还原剂是________(填元素符号)。
(3)若反应中转移电子3mol,则在反应中消耗Al________mol。
(4)用双线桥法表示下列反应的电子转移情况:________。
Zn + 2HCl = ZnCl2+ H2↑
【答案】 Al H HCl Al 1 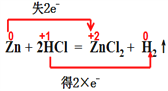
【解析】(1)根据方程式可知Al元素化合价从0价升高到+3价,失去3个电子,氢元素化合价从+1价降低到0价,得到1个电子,因此该反应被氧化的元素是Al,被还原的元素是H;(2)根据以上分析可知该反应中氧化剂是HCl,还原剂是Al;(3)若反应中转移电子3mol,则在反应中消耗Al的物质的量是1mol;(4)根据方程式可知Zn元素化合价从0价升高到+2价,失去2个电子,氢元素化合价从+1价降低到0价,得到1个电子,因此用双线桥法表示该反应的电子转移情况为 。
。

练习册系列答案
相关题目

