题目内容
往硫酸与硝酸的混合溶液中投入一块未除氧化膜的铝箔,微热使之完全反应,产生2.24L (已折算为标准状况)NO与H2的混合气体,且该混合气体的平均摩尔质量为13.20g/mol.
(1)若将混合气体与一定量的氧气在一定条件下充分反应后,恰好全部转化为硝酸溶液.
①混合气体中NO的体积分数为______.②所用氧气在标准状况下的体积为______L.
(2)向铝箔与混酸反应后的溶液中趁热加入一定质量的(NH4)2SO4,冷却后全部溶液正好转化为40.77g铝铵矾晶体[化学式:NH4Al(SO4)2?12H2O,式量:453].
①原铝箔中金属铝的质量为______,氧化膜的物质的量为______.
②计算原混酸中硫酸的质量分数(精确到0.001,写出计算过程)______.
(3)另取铝铵矾溶于水后按一定比例加到碳酸氢铵溶液中,既有气体又有沉淀生成.取27.8g沉淀,平均分为两份.
第一份加强热使其完全分解,最终得到5.1g氧化铝粉末.
第二份加入足量的盐酸,固体完全溶解,生成0.1mol气体.往所得溶液中加入足量的NaOH并微热,又生成0.1mol气体.
通过计算推测沉淀的化学式并写出生成该沉淀的化学方程式______.
解:(1)①混合气体的物质的量为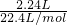 =0.1mol,令NO与H2的物质的量分别为xmol、ymol,则:
=0.1mol,令NO与H2的物质的量分别为xmol、ymol,则:
x+y=0.1, =13.2,联立方程,解得x=0.04,y=0.06,
=13.2,联立方程,解得x=0.04,y=0.06,
故NO的体积分数为 =0.4,
=0.4,
故答案为:0.4;
②NO转化为HNO3,H2中氢原子反应后存在HNO3、H2O中,由①中计算可知n(NO)=0.04mol、n(H2)=0.06mol,由氮原子守恒可得n(HNO3)=n(NO)=0.04mol,由H原子守恒可知2n(H2)=2n(H2O)+n(HNO3),即0.06mol×2=2n(H2O)+0.04mol,解得n(H2O)=0.04mol,根据氧原子守恒有:2n(O2)+n(NO)=3n(HNO3)+n(H2O),故2n(O2)+0.04mol=3×0.04mol+0.04mol,解得n(O2)=0.06mol,故V(O2)=0.06mol×22.4L/mol=1.344L,
故答案为:1.344L;
(2)①根据电子转移守恒,铝箔中n(Al)= =0.08mol,故m(Al)=0.08mol×27g/mol=2.16g,
=0.08mol,故m(Al)=0.08mol×27g/mol=2.16g,
40.77g铝铵矾晶体的物质的量为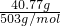 =0.09mol,由铝元素守恒可知,2n(Al2O3)+0.08mol=0.09mol,故n(Al2O3)=0.005mol,
=0.09mol,由铝元素守恒可知,2n(Al2O3)+0.08mol=0.09mol,故n(Al2O3)=0.005mol,
故答案为:2.16g;0.005mol;
②根据铵根守恒可知n[(NH4)2SO4]= =0.045mol,故m[(NH4)2SO4]=0.045mol×132g/mol=5.94g,根据硫酸根守恒可知n(H2SO4)=0.09mol×2-0.045mol=0.135mol,故m(H2SO4)=0.135×98g,
=0.045mol,故m[(NH4)2SO4]=0.045mol×132g/mol=5.94g,根据硫酸根守恒可知n(H2SO4)=0.09mol×2-0.045mol=0.135mol,故m(H2SO4)=0.135×98g,
m(Al2O3)=0.005mol×102g/mol=0.51g,m(混酸)+m(铝箔)+m[(NH4)2SO4]-m(气体)=m(铝铵矾晶体),故m(混酸)+2.16g+0.51g+5.94g-0.1mol×13.2g/mol=40.77g,故m(混酸)=40.77-2.16g-0.51g-5.94g+0.1mol×13.2g/mol=33.48g,故原混酸中硫酸的质量分数为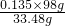 =0.395,
=0.395,
故答案为:0.395;
(2)n(Al2O3)= =0.05mol,由氧原子守恒n(Al3+)=2n(Al2O3)=0.1mol,
=0.05mol,由氧原子守恒n(Al3+)=2n(Al2O3)=0.1mol,
加入足量的盐酸,固体完全溶解,生成0.1mol气体为二氧化碳,由碳元素守恒n(CO32-)=0.1mol,
所得溶液中加入足量的NaOH并微热,又生成0.1mol气体为氨气,由氮元素守恒可知n(NH4+)=0.1mol,
三种离子的质量为0.1mol×(27g/mol+60g/mol+18g/mol)=10.5g,小于13.9g,少13.9g-10.5g=3.4g,
电荷0.1mol×3+0.1mol>0.1mol×2,由电荷守恒与质量守恒可知,缺少阴离子,缺少的阴离子为OH-,而非SO42-,故n(OH-)=0.1mol×3+0.1mol-0.1mol×2=0.2mol,
沉淀中含Al3+、NH4+、CO32-各0.1mol,OH-为0.2mol,故沉淀的化学式为:NH4Al(OH)2CO3,
生成沉淀的方程式为:NH4Al(SO4)2+4NH4HCO3=NH4Al(OH)2CO3↓+2(NH4)2SO4+3CO2↑+H2O,
故答案为:NH4Al(OH)2CO3;NH4Al(SO4)2+4NH4HCO3=NH4Al(OH)2CO3↓+2(NH4)2SO4+3CO2↑+H2O.
分析:(1)①根据n= 计算混合气体的物质的量,令NO与H2的物质的量分别为xmol、ymol,根据二者物质的量之和与平均摩尔质量列方程计算x、y的值,进而计算NO的体积分数;
计算混合气体的物质的量,令NO与H2的物质的量分别为xmol、ymol,根据二者物质的量之和与平均摩尔质量列方程计算x、y的值,进而计算NO的体积分数;
②NO转化为HNO3,H2中氢原子反应后存在HNO3、H2O中,由①中计算得到NO与H2的物质的量,利用原子守恒计算HNO3、H2O的物质的量,根据氧原子守恒有:2n(O2)+n(NO)=3n(HNO3)+n(H2O),再根据V=nVm计算氧气体积;
(2)①根据电子转移守恒计算金属Al的物质的量,再根据m=nM计算铝箔中金属Al的质量;
根据n= 计算40.77g铝铵矾晶体的物质的量,利用铝元素守恒计算n(Al2O3);
计算40.77g铝铵矾晶体的物质的量,利用铝元素守恒计算n(Al2O3);
②根据铵根守恒计算n[(NH4)2SO4],再根据m=nM计算m[(NH4)2SO4],根据硫酸根守恒计算n(H2SO4),进而计算m(H2SO4),m(混酸)+m(铝箔)+m[(NH4)2SO4]-m(气体)=m(铝铵矾晶体),据此计算原混酸的质量,再根据质量分数定义计算;
(3)根据n= 计算5.1g氧化铝的物质的量,由铝原子守恒n(Al3+)=2n(Al2O3),加入足量的盐酸,固体完全溶解,生成0.1mol气体为二氧化碳,所得溶液中加入足量的NaOH并微热,又生成0.1mol气体为氨气,根据元素守恒计算n(CO32-)、n(NH4+),由电荷守恒与质量守恒判断是否缺少阴离子,据此判断化学式,书写方程式.
计算5.1g氧化铝的物质的量,由铝原子守恒n(Al3+)=2n(Al2O3),加入足量的盐酸,固体完全溶解,生成0.1mol气体为二氧化碳,所得溶液中加入足量的NaOH并微热,又生成0.1mol气体为氨气,根据元素守恒计算n(CO32-)、n(NH4+),由电荷守恒与质量守恒判断是否缺少阴离子,据此判断化学式,书写方程式.
点评:本题考查化学计算,题目很大,计算量很大,过程复杂,主要考查学生守恒思想的利用,是对学生综合能量的考查,对学生的心理素质由很高的要求,难度很大,为易错题目.
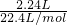 =0.1mol,令NO与H2的物质的量分别为xmol、ymol,则:
=0.1mol,令NO与H2的物质的量分别为xmol、ymol,则:x+y=0.1,
 =13.2,联立方程,解得x=0.04,y=0.06,
=13.2,联立方程,解得x=0.04,y=0.06,故NO的体积分数为
 =0.4,
=0.4,故答案为:0.4;
②NO转化为HNO3,H2中氢原子反应后存在HNO3、H2O中,由①中计算可知n(NO)=0.04mol、n(H2)=0.06mol,由氮原子守恒可得n(HNO3)=n(NO)=0.04mol,由H原子守恒可知2n(H2)=2n(H2O)+n(HNO3),即0.06mol×2=2n(H2O)+0.04mol,解得n(H2O)=0.04mol,根据氧原子守恒有:2n(O2)+n(NO)=3n(HNO3)+n(H2O),故2n(O2)+0.04mol=3×0.04mol+0.04mol,解得n(O2)=0.06mol,故V(O2)=0.06mol×22.4L/mol=1.344L,
故答案为:1.344L;
(2)①根据电子转移守恒,铝箔中n(Al)=
 =0.08mol,故m(Al)=0.08mol×27g/mol=2.16g,
=0.08mol,故m(Al)=0.08mol×27g/mol=2.16g,40.77g铝铵矾晶体的物质的量为
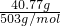 =0.09mol,由铝元素守恒可知,2n(Al2O3)+0.08mol=0.09mol,故n(Al2O3)=0.005mol,
=0.09mol,由铝元素守恒可知,2n(Al2O3)+0.08mol=0.09mol,故n(Al2O3)=0.005mol,故答案为:2.16g;0.005mol;
②根据铵根守恒可知n[(NH4)2SO4]=
 =0.045mol,故m[(NH4)2SO4]=0.045mol×132g/mol=5.94g,根据硫酸根守恒可知n(H2SO4)=0.09mol×2-0.045mol=0.135mol,故m(H2SO4)=0.135×98g,
=0.045mol,故m[(NH4)2SO4]=0.045mol×132g/mol=5.94g,根据硫酸根守恒可知n(H2SO4)=0.09mol×2-0.045mol=0.135mol,故m(H2SO4)=0.135×98g,m(Al2O3)=0.005mol×102g/mol=0.51g,m(混酸)+m(铝箔)+m[(NH4)2SO4]-m(气体)=m(铝铵矾晶体),故m(混酸)+2.16g+0.51g+5.94g-0.1mol×13.2g/mol=40.77g,故m(混酸)=40.77-2.16g-0.51g-5.94g+0.1mol×13.2g/mol=33.48g,故原混酸中硫酸的质量分数为
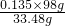 =0.395,
=0.395,故答案为:0.395;
(2)n(Al2O3)=
 =0.05mol,由氧原子守恒n(Al3+)=2n(Al2O3)=0.1mol,
=0.05mol,由氧原子守恒n(Al3+)=2n(Al2O3)=0.1mol,加入足量的盐酸,固体完全溶解,生成0.1mol气体为二氧化碳,由碳元素守恒n(CO32-)=0.1mol,
所得溶液中加入足量的NaOH并微热,又生成0.1mol气体为氨气,由氮元素守恒可知n(NH4+)=0.1mol,
三种离子的质量为0.1mol×(27g/mol+60g/mol+18g/mol)=10.5g,小于13.9g,少13.9g-10.5g=3.4g,
电荷0.1mol×3+0.1mol>0.1mol×2,由电荷守恒与质量守恒可知,缺少阴离子,缺少的阴离子为OH-,而非SO42-,故n(OH-)=0.1mol×3+0.1mol-0.1mol×2=0.2mol,
沉淀中含Al3+、NH4+、CO32-各0.1mol,OH-为0.2mol,故沉淀的化学式为:NH4Al(OH)2CO3,
生成沉淀的方程式为:NH4Al(SO4)2+4NH4HCO3=NH4Al(OH)2CO3↓+2(NH4)2SO4+3CO2↑+H2O,
故答案为:NH4Al(OH)2CO3;NH4Al(SO4)2+4NH4HCO3=NH4Al(OH)2CO3↓+2(NH4)2SO4+3CO2↑+H2O.
分析:(1)①根据n=
 计算混合气体的物质的量,令NO与H2的物质的量分别为xmol、ymol,根据二者物质的量之和与平均摩尔质量列方程计算x、y的值,进而计算NO的体积分数;
计算混合气体的物质的量,令NO与H2的物质的量分别为xmol、ymol,根据二者物质的量之和与平均摩尔质量列方程计算x、y的值,进而计算NO的体积分数;②NO转化为HNO3,H2中氢原子反应后存在HNO3、H2O中,由①中计算得到NO与H2的物质的量,利用原子守恒计算HNO3、H2O的物质的量,根据氧原子守恒有:2n(O2)+n(NO)=3n(HNO3)+n(H2O),再根据V=nVm计算氧气体积;
(2)①根据电子转移守恒计算金属Al的物质的量,再根据m=nM计算铝箔中金属Al的质量;
根据n=
 计算40.77g铝铵矾晶体的物质的量,利用铝元素守恒计算n(Al2O3);
计算40.77g铝铵矾晶体的物质的量,利用铝元素守恒计算n(Al2O3);②根据铵根守恒计算n[(NH4)2SO4],再根据m=nM计算m[(NH4)2SO4],根据硫酸根守恒计算n(H2SO4),进而计算m(H2SO4),m(混酸)+m(铝箔)+m[(NH4)2SO4]-m(气体)=m(铝铵矾晶体),据此计算原混酸的质量,再根据质量分数定义计算;
(3)根据n=
 计算5.1g氧化铝的物质的量,由铝原子守恒n(Al3+)=2n(Al2O3),加入足量的盐酸,固体完全溶解,生成0.1mol气体为二氧化碳,所得溶液中加入足量的NaOH并微热,又生成0.1mol气体为氨气,根据元素守恒计算n(CO32-)、n(NH4+),由电荷守恒与质量守恒判断是否缺少阴离子,据此判断化学式,书写方程式.
计算5.1g氧化铝的物质的量,由铝原子守恒n(Al3+)=2n(Al2O3),加入足量的盐酸,固体完全溶解,生成0.1mol气体为二氧化碳,所得溶液中加入足量的NaOH并微热,又生成0.1mol气体为氨气,根据元素守恒计算n(CO32-)、n(NH4+),由电荷守恒与质量守恒判断是否缺少阴离子,据此判断化学式,书写方程式.点评:本题考查化学计算,题目很大,计算量很大,过程复杂,主要考查学生守恒思想的利用,是对学生综合能量的考查,对学生的心理素质由很高的要求,难度很大,为易错题目.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
下列说法正确的是
| A.浓硫酸、浓硝酸、稀硝酸都是氧化性酸,常温下都能使金属铝钝化 |
| B.浓硫酸与蔗糖混合搅拌产生有刺激性气味的气体,此过程只体现了浓硫酸的脱水性 |
| C.往某溶液中加盐酸产生能使澄清石灰水变浑浊的气体,说明该溶液中一定含CO32-或SO32- |
| D.向某溶液中滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀,不能说明该溶液中一定含SO42- |