题目内容
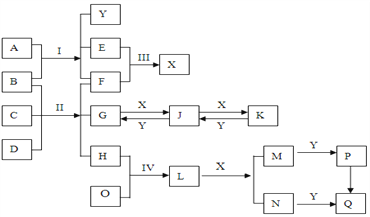
【题目】中学化学中常见化学物质反应关系如下图。反应I、II、III、IV没有省略反应物和生成物;其他反应省略部分参与反应物质。D、O是常见金属,B常温下呈液态。C为淡黄色粉末,L为黑色固体且有磁性,Q为红褐色沉淀。E、F、H为常见气体。反应I条件为电解,是工业上重要的电解反应。
(1)P可以在溶液转变成Q,现象是_______________________
(2)C的电子式为___________________。
(3)D和L在一定条件下可以发生反应,该反应可放出大量的热。写出该反应的化学方程式________。
(4)a g C、D的混合物可以与b g B反应得到只含一种溶质的 c mL溶液,产生气体体积为V L,下列说法正确的是________________
A.V L气体中F和H的物质的量比为6:1
B.所得溶液密度为 ![]() g/mL
g/mL
C.向所得溶液中通入HCl气体,恰好使溶液中沉淀质量最大,则气体物质的量为![]() mol
mol
D.溶液的物质的量浓度为![]() mol/L
mol/L
(5)写出G溶液和K溶液混合反应的离子方程式________________________________。
(6)将一定量C加入M溶液中,若恰好将M溶液中阳离子氧化,写出该反应离子方程式________
【答案】 白色沉淀迅速变为灰绿色,最终变为红褐色 略 8Al + 3Fe3O4 ![]() 4Al2O3 + 9Fe A D Al3+ + 3AlO2- + 6H2O = 4Al(OH)3↓ 6Fe2+ + 3Na2O2 + 6H2O = 4Fe(OH)3↓ + 2Fe3+ + 6Na+
4Al2O3 + 9Fe A D Al3+ + 3AlO2- + 6H2O = 4Al(OH)3↓ 6Fe2+ + 3Na2O2 + 6H2O = 4Fe(OH)3↓ + 2Fe3+ + 6Na+
【解析】D、O是常见金属,E、F、H为常见气体。B常温下呈液态,B可能是水。C为淡黄色粉末,C可能是过氧化钠。L为黑色固体且有磁性,Q为红褐色沉淀,所以L是四氧化三铁,Q是氢氧化铁,则O是铁,因此H是氧气。反应I条件为电解,是工业上重要的电解反应,因此A是氯化钠,所以Y是氢氧化钠,E是氯气,F是氢气,G是偏铝酸钠,D是铝,X是氯化氢,J是氢氧化铝,K是氯化铝,M是氯化亚铁,N是氯化铁,P是氢氧化亚铁。则
(1)P可以在溶液转变成Q,现象是白色沉淀迅速变为灰绿色,最终变为红褐色。(2)过氧化钠是离子化合物,电子式为![]() 。(3)D和L在一定条件下可以发生铝热反应,该反应可放出大量的热,反应的化学方程式为8Al + 3Fe3O4
。(3)D和L在一定条件下可以发生铝热反应,该反应可放出大量的热,反应的化学方程式为8Al + 3Fe3O4![]() 4Al2O3 + 9Fe。(4)a g 过氧化钠、铝的混合物可以与b g 水反应得到只含一种溶质的 c mL溶液,产生气体体积为V L,溶质是偏铝酸钠,反应的化学方程式为2Na2O2+4Al+6H2O=4NaAlO2+O2↑+6H2↑,则A.V L气体中氢气和氧气的物质的量比为6:1,A正确;B.根据质量守恒定律可知反应后溶液的质量小于(a+b)g,因此所得溶液密度小于
4Al2O3 + 9Fe。(4)a g 过氧化钠、铝的混合物可以与b g 水反应得到只含一种溶质的 c mL溶液,产生气体体积为V L,溶质是偏铝酸钠,反应的化学方程式为2Na2O2+4Al+6H2O=4NaAlO2+O2↑+6H2↑,则A.V L气体中氢气和氧气的物质的量比为6:1,A正确;B.根据质量守恒定律可知反应后溶液的质量小于(a+b)g,因此所得溶液密度小于![]() g/mL,B错误;C.气体不一定处于标准状况下,因此不能计算气体的物质的量,C错误;D.设混合物中铝的物质的量是4x,过氧化钠是2x,则2x×78+4x×27=a,解得x=a/264mol,根据方程式可知偏铝酸钠的物质的量是4a/264mol,因此溶液的物质的量浓度为
g/mL,B错误;C.气体不一定处于标准状况下,因此不能计算气体的物质的量,C错误;D.设混合物中铝的物质的量是4x,过氧化钠是2x,则2x×78+4x×27=a,解得x=a/264mol,根据方程式可知偏铝酸钠的物质的量是4a/264mol,因此溶液的物质的量浓度为![]() mol/L,D正确,答案选AD;(5)根据以上分析可知G溶液和K溶液混合反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓。(6)将一定量C加入M溶液中,若恰好将M溶液中阳离子氧化,即过氧化钠氧化亚铁离子,因此根据电子得失守恒和原子守恒可知该反应离子方程式为6Fe2++3Na2O2+6H2O=4Fe(OH)3↓+2Fe3+ +6Na+。
mol/L,D正确,答案选AD;(5)根据以上分析可知G溶液和K溶液混合反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓。(6)将一定量C加入M溶液中,若恰好将M溶液中阳离子氧化,即过氧化钠氧化亚铁离子,因此根据电子得失守恒和原子守恒可知该反应离子方程式为6Fe2++3Na2O2+6H2O=4Fe(OH)3↓+2Fe3+ +6Na+。