题目内容
【题目】(1)原子是由________和________构成的,原子核是由_______和_______构成的,(_______)的原子核中只有质子),原子的质量主要取决于_________的质量。
(2)写出下列物质的电子式Mg__________ Cl-__________NaCl __________ HCl _____
【答案】 原子核 核外电子 质子 中子 11H 原子核 ![]()
![]()
![]()
![]()
【解析】(1)根据原子的结构及其带电情况分析解答,氢原子原子核中没有中子,电子的质量很小。
(2)镁原子最外层有两个电子;Cl-最外层有8个电子,为阴离子,加括号并标明电荷数;NaCl含离子键,由钠离子和氯离子构成;HCl只含共价键,存在共用电子对,以此来解答。
(1)原子是由原子核和核外电子构成的,而原子核一般是由质子和中子构成的,其中质子带正电荷,中子不带电。氢原子原子核中没有中子,电子的质量很小,所以原子的质量主要集中在原子核上;
因此,本题正确答案是:原子核;核外电子;质子;中子;![]() ;原子核。
;原子核。
(2)Mg原子最外层有两个电子,电子式为:![]() ;氯离子最外层为8电子,氯离子的电子式为:
;氯离子最外层为8电子,氯离子的电子式为:![]() ;NaCl是由钠离子和氯离子离子构成的离子化合物,其电子式为
;NaCl是由钠离子和氯离子离子构成的离子化合物,其电子式为![]() ;HCl属于共价化合物,不存在离子键,分子中氢原子与氯原子之间形成1对共用电子对,HCl电子式为
;HCl属于共价化合物,不存在离子键,分子中氢原子与氯原子之间形成1对共用电子对,HCl电子式为![]() ,因此,本题正确答案是:氯离子最外层为8电子,氯离子的电子式为:
,因此,本题正确答案是:氯离子最外层为8电子,氯离子的电子式为:![]() ;
;![]() ;
;![]() ;
;![]() 。
。

【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣5molL﹣1 | K1=4.4×10﹣7molL﹣1 | 3.0×10﹣8 |
请回答下列问题:
(1)同浓度的CH3COO﹣、HCO3﹣、CO32﹣、ClO﹣结合H+的能力由强到弱的顺序为 .
(2)常温下0.1molL﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是(填字母序号,下同).
A.c(H+) B. ![]() C.c(H+)c(OH﹣)
C.c(H+)c(OH﹣)
D. ![]() E.
E. ![]()
若该溶液升高温度,上述5种表达式的数据增大的是 .
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图: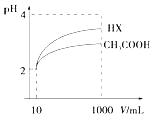
则HX的电离平衡常数(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中由水电离出来的c(H+)(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是 .
(4)已知100℃时,水的离子积为1×10﹣12 , 该温度下测得某溶液pH=7,该溶液显(填“酸”、“碱”或“中”)性.将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a:b= .
