题目内容
在乙烯分子中有5个σ键、一个π键,它们分别是
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键
D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键
【答案】
A
【解析】
试题分析:单键都是σ键,而双键是由1个σ键和1个π键构成的。又因为杂化轨道只能形成单键,而未参与杂化的形成π键,所以由乙烯的结构式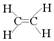 可知,分子中有5个σ键、一个π键,它们分别是sp2杂化轨道形成σ键、未杂化的2p轨道形成π键,答案选A。
可知,分子中有5个σ键、一个π键,它们分别是sp2杂化轨道形成σ键、未杂化的2p轨道形成π键,答案选A。
考点:考查化学键、杂化轨道的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题。该题的关键是明确σ键、π键以及杂化轨道的含义和判断依据,并能结合题意和结构式灵活运用即可,有利于培养学生的逻辑思维能力和空间想象能力,有助于提升学生的学科素养。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在乙烯分子中有5个σ键、一个π键,它们分别是
| A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 |
| B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键 |
| C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键 |
| D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键 |