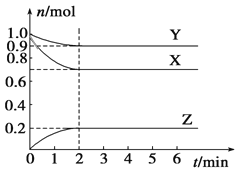
题目内容
【题目】短周期主族元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知X的最低负价与Y的最髙正价代数和为零,下列说法正确的是
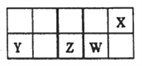
A. X分别与Z、W形成的化合物熔点顺序:Z>W
B. 原子半径的大小顺序:r(X)>r(Y)>r(Z)>r(W)
C. Z的最高价氧化物的水化物酸性比W的强
D. X的简单气态氢化物的稳定性比W的弱
【答案】A
【解析】短周期主族元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知X的最低负价与Y的最髙正价代数和为零,下列说法正确的是
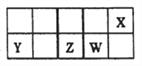
试题分析:由题意知,X、Y、Z、W分别为O、Mg、Si、P。A. X分别与Z、W形成的化合物是二氧化硅和五氧化二磷,二氧化硅是原子晶体,五氧化二磷是分子晶体,所以二氧化硅熔点较高,A正确;B. 原子半径的大小顺序r(Y)>r(Z)>r(W) > r(X),B不正确;C. Z的最高价氧化物的水化物硅酸酸性比硫酸弱,C不正确;D. X的简单气态氢化物水的稳定性比硫化氢强,D不正确。本题选A。

 阅读快车系列答案
阅读快车系列答案【题目】碳及化合物在生产生活中用比较广泛。回答下列问题:
(1)已知:①H2(g)+ ![]() O2(g)=H2O(1)△H1=-285.8kJ·mol-1
O2(g)=H2O(1)△H1=-285.8kJ·mol-1
②CH3OH(1)+ ![]() O2(g)=CO2(g)+2H2O(1) △H2=-725.5kJ·mol-1
O2(g)=CO2(g)+2H2O(1) △H2=-725.5kJ·mol-1
则CO2(g)+3H2(g)=CH2OH(1)+H2O(1)的反应热 △H=____________。
(2)某研究小组用CO合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)△H<0,将三组混合气体分别通入到三个2L恒容密闭容器中进行反应,得到如下三组实验数据:
CH3OH(g)△H<0,将三组混合气体分别通入到三个2L恒容密闭容器中进行反应,得到如下三组实验数据:
实验组 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | 达到平衡所需的时间/min | ||||
CO | H2 | CH3OH | CO | H2 | CH3OH | |||
1 | 650 | 2.0 | 6.0 | 0 | 1.0 | 5 | ||
2 | 900 | 2.0 | 6.0 | 0 | 1.2 | 2 | ||
3 | 650 | 1.0 | 4.0 | 2.0 | a | b | c | t |
实验1条件下平衡常数K=__________,a、b之间可能的关系为_____________。
已知反应CO(g)+2H2(g)![]() CH3OH(g)中CO的转化率(a)与温度(T)、压强(p)的关系如右图所示:
CH3OH(g)中CO的转化率(a)与温度(T)、压强(p)的关系如右图所示:

①p1______p2(填“<”“>”“=”)。先升高温度、后增大压强,能否实现b点到c点的转化?__________(填“能”或“不能”),原因是_____________________________________________。
②a、c两点的反应速率为v1________v2(填“<”“>”“=”)。
③在不改变反应物用量情况下,为提高CO的转化率可采取的措施是_____________(答出三条措施)。