题目内容
 【选修3:物质结构与性质】
【选修3:物质结构与性质】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子核外有成单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:
(1)写出基态E原子的价电子排布式
(2)A的单质分子中π键的个数为
(3)A、B、C三种元素第一电离能由大到小的顺序为
(4)B元素的氢化物的沸点是同族元素中最高的,原因是
(5)A的最简单氢化物分子的空间构型为
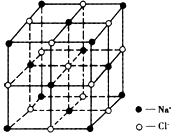
(6)C和D形成的化合物的晶胞结构如图,已知晶体的密度为ρg?cm-3,阿伏加德罗常数为NA,求晶胞边长a=
分析:有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30),A的基态原子2p能级有3个单电子,原子核外电子排布为1s22s22p3,则A是N元素;C的基态原子2p能级有1个单电子,且C的原子序数大于A,其原子核外电子排布为1s22s22p5,所以C是F元素,结合原子序数可推知B是O元素;E原子核外有成单电子,其次外层有3个能级且均排满电子,且原子序数小于30,则E处于第四周期,其基态原子的价电子排布式[Ar]3d104s1,则E是Cu元素;D与E同周期,价电子数为2,则D是Ca元素,据此解答.
解答:解:有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30),A的基态原子2p能级有3个单电子,原子核外电子排布为1s22s22p3,则A是N元素;C的基态原子2p能级有1个单电子,且C的原子序数大于A,其原子核外电子排布为1s22s22p5,所以C是F元素,结合原子序数可推知B是O元素;E原子核外有成单电子,其次外层有3个能级且均排满电子,且原子序数小于30,则E处于第四周期,其基态原子的价电子排布式[Ar]3d104s1,则E是Cu元素;D与E同周期,价电子数为2,则D是Ca元素,
(1)E是铜元素,根据构造原理知,其基态原子的价电子排布式[Ar]3d104s1,故基态Cu原子的价电子排布式为:3d104s1,故答案为:3d104s1;
(2)氮气的结构式为:N≡N,所以氮气分子中含有一个σ键两个π键,故答案为:2;
(3)同一周期中,元素的第一电离能随着原子序数的增大呈增大趋势,但N元素2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能大于同周期相邻元素,素第一电离能由大到小的顺序为F>N>O,
故答案为:F>N>O;
(4)水分子间能存在氢键,氢键比范德华力更强,H2O的沸点是同族元素中最高的,
故答案为:水分子间之间存在氢键,氢键比范德华力更强;
(5)N元素的简单氢化物是氨气,NH3分子中氮原子价层电子对=3+
=4,且含有一个孤电子对,所以分子空间构型是三角锥形,N原子采取sp3杂化,
故答案为:三角锥形;sp3;
(6)F和Ca形成的化合物为CaF2,由晶胞结构可知,晶胞中白色球数目=8、黑色球数目=8×
+6×
=4,白色球为F、黑色球为Ca,则晶胞质量=4×
=
g,晶胞的体积=
=
cm3,故晶胞边长a=
cm,
故答案为:
.
(1)E是铜元素,根据构造原理知,其基态原子的价电子排布式[Ar]3d104s1,故基态Cu原子的价电子排布式为:3d104s1,故答案为:3d104s1;
(2)氮气的结构式为:N≡N,所以氮气分子中含有一个σ键两个π键,故答案为:2;
(3)同一周期中,元素的第一电离能随着原子序数的增大呈增大趋势,但N元素2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能大于同周期相邻元素,素第一电离能由大到小的顺序为F>N>O,
故答案为:F>N>O;
(4)水分子间能存在氢键,氢键比范德华力更强,H2O的沸点是同族元素中最高的,
故答案为:水分子间之间存在氢键,氢键比范德华力更强;
(5)N元素的简单氢化物是氨气,NH3分子中氮原子价层电子对=3+
| 5-1×3 |
| 2 |
故答案为:三角锥形;sp3;
(6)F和Ca形成的化合物为CaF2,由晶胞结构可知,晶胞中白色球数目=8、黑色球数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 78g |
| NA |
| 312 |
| NA |
| ||
| ρ g?cm-3 |
| 312 |
| ρ?NA |
| 3 |
| ||
故答案为:
| 3 |
| ||
点评:本题考查物质结构与性质,涉及核外电子排布、分子空间构型、化学键、杂化方式、电离能、晶胞计算等,都是考试热点,注意第一电离能的变化趋势及异常现象,为易错点.

练习册系列答案
相关题目