题目内容
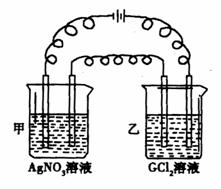
 用石墨作电极,电解盛放在U形管中的饱和NaCl溶液(滴有酚酞溶液),如图.下列叙述正确的是( )
用石墨作电极,电解盛放在U形管中的饱和NaCl溶液(滴有酚酞溶液),如图.下列叙述正确的是( )分析:石墨电极,电解饱和氯化钠溶液,阴极发生还原反应,电极反应式为:2H2O+2e-=H2↑+2OH-,有碱生成,该极呈碱性;阳极发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,总反应为:2Cl-+2H2O
2OH-+H2↑+Cl2↑,据此解答.
| ||
解答:解:A.阴极发生还原反应,电极反应式为:2H2O+2e-=H2↑+2OH-,有碱生成,溶液先变红,故A正确;
B.阳极发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,阴极发生还原反应,电极反应式为:2H2O+2e-=H2↑+2OH-,故B错误;
C.总反应式为:2Cl-+2H2O
2OH-+H2↑+Cl2↑,有氢氧化钠生成,溶液呈碱性,故C错误;
D.阳极发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,生成0.1mol氯气时,转移电子为0.2mole-,故D错误;
故选A.
B.阳极发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,阴极发生还原反应,电极反应式为:2H2O+2e-=H2↑+2OH-,故B错误;
C.总反应式为:2Cl-+2H2O
| ||
D.阳极发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,生成0.1mol氯气时,转移电子为0.2mole-,故D错误;
故选A.
点评:本题考查电解原理,难度中等,掌握离子放电顺序是解题的关键,注意基础知识的积累掌握.

练习册系列答案
相关题目