题目内容
电池是人类生产、生活中重要的能量来源,各种电池的发明是化学对人类的一项重大贡献。下列有关电池的叙述正确的是
| A.锌锰干电池工作一段时间后碳棒变细 |
| B.氢氧燃料电池可将热能直接转变为电能 |
| C.氢氧燃料电池工作时氢气在负极被氧化 |
| D.太阳能电池的主要材料是高纯度的二氧化硅 |
C
解析试题分析:A、在锌锰干电池中,锌筒是负极,失去电子被氧化。正极是碳棒,该极上二氧化锰发生得电子的还原反应,该电极质量不会减少,故A错误;B、氢氧燃料电池属于原电池的一种,是将化学能转化为电能的装置,不能将热能直接转变为电能,故B错误;C、氢氧燃料电池中,燃料做负极,发生失电子的氧化反应,被氧化,故C正确;D、太阳能电池的主要材料是半导体硅,不是二氧化硅,二氧化硅可以用光导纤维,故D错误,答案选C。
考点:考查常见化学电源工作原理的判断

练习册系列答案
相关题目
如图为用惰性电极电解CuCl2溶液,并验证其产物的实验装置,则下列说法不正确的是 ( )
| A.电源a极为负极 |
| B.KI—淀粉溶液会变蓝 |
| C.可以将惰性电极Ⅰ换为铜棒 |
| D.惰性电极Ⅰ上发生的电极反应为:Cu-2e-=Cu2+ |
如图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
| A.a为负极、b为正极 |
| B.a为阳极、b为阴极 |
| C.电解过程中,d电极质量增加 |
| D.电解过程中,氯离子浓度不变 |
在如图所示的装置中,a为Fe,b为碳棒,关于此装置的各种叙述正确的是
| A.a电极上有气体放出,b电极上无气泡,溶液pH变大 |
| B.a是正极,b是负极 |
| C.导线中有电子流动,外电路中,电子从a极到b极 |
| D.a极上发生了还原反应 |
把锌片和铁片放在盛有含酚酞的稀食盐水的玻璃器皿中,如下图。经过一段时间后,首先观察到溶液变红的区域是( )
| A.Ⅰ和Ⅲ附近 | B.Ⅰ和Ⅳ附近 |
| C.Ⅱ和Ⅲ附近 | D.Ⅱ和Ⅳ附近 |
某固体燃料电池以固体氧化铝——氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a.b均不参与电极反应。下列判断不正确的是
| A.在电池内部氧离子(O2-)向负极移动 |
| B.b极对应的电极反应式为:C3H8+10O2-—20e-=3CO2+4H2O |
| C.该电池的总反应方程式为:C3H8+5O2=3CO2+4H2O |
| D.用该电池做电源电解CuSO4溶液时,每消耗1molC3H8时理论上能得到Cu的最大量为5mol |
已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH +2H2O  Cd(OH)2 + 2Ni(OH)2,有关该电池的说法正确的是( )
Cd(OH)2 + 2Ni(OH)2,有关该电池的说法正确的是( )
| A.充电过程是化学能转化为电能的过程 |
| B.充电时阳极反应:Ni(OH)2-e- + OH-=" NiOOH" + H2O |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH-向正极移动 |
钠硫高能蓄电池的结构如图,M为Na2O和Al2O3的混合物,电池的反应原理为 电池工作温度为320℃。下列说法错误的是
电池工作温度为320℃。下列说法错误的是
| A.a为电池正极,b为电池负极 |
B.电池放电时,正极反应为 |
| C.电池充电时.Na所在电极连接电源正极 |
| D.M的作用为导电和隔离钠和硫 |
某原电池的结构如图所示,下列有关该原电池的说法中不正确盼是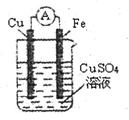
| A.铁棒为正极 |
| B.铜棒发生还原反应 |
| C.电流从铜棒经外电路流向铁棒 |
| D.铁棒质量减轻 |