题目内容
13.Cl2在70℃的NaOH水溶液中,发生氧化还原反应,反应完全后测得溶液中NaClO与NaClO3的物质的量之比为1:2,则回答下列问题.(1)写出化学反应方程式并用双线桥标出电子转移的方向和数目.
(2)反应中被氧化的Cl2与被还原的Cl2的物质的量之比为3:11.
分析 先通过氯元素化合价的对比判断NaClO与NaClO3是氧化产物,氯气得电子化合价降低的产物是还原产物,所以还原产物是氯化钠,根据氧化还原反应中得失电子数相等配平方程式,以此用双线桥标出电子转移的方向和数目,根据方程式结合化合价变化计算被氧化的Cl2与被还原的Cl2的物质的量之比.
解答 解:(1)该反应中NaClO与NaClO3是氧化产物,氯化钠是还原产物,根据反应完全后测得溶液中NaClO与NaClO3的物质的量之比为1:2,则失去1+5×2=11e-,所以得到也是11e-,则生成11NaCl,所以该方程式为:7Cl2+14NaOH=NaClO+2NaClO3+11NaCl+7H2O,双线桥标出电子转移的方向和数目为: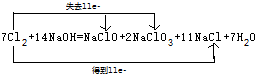 ,故答案为:
,故答案为: ;
;
(2)由方程式7Cl2+14NaOH=NaClO+2NaClO3+11NaCl+7H2O,则氧化产物对应的氯气是还原剂,还原剂被氧化,还原产物对应的氯气是氧化剂,氧化剂被还原,
所以则反应中被氧化的Cl2与被还原的Cl2的物质的量之比=$\frac{1}{2}$(1+2):$\frac{1}{2}$×11=3:11,故答案为:3:11.
点评 本题考查了有关氧化还原反应的计算,难度不大,明确NaClO与NaClO3都是氧化产物是解本题的关键,然后根据得失电子相等配平方程式即可解答.

练习册系列答案
相关题目
3.100mL pH=2的两种一元酸x和y,稀释过程中pH与溶液体积的关系如图所示.则下列有关叙述正确的是( )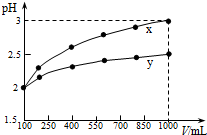

| A. | x为强酸,y为弱酸 | |
| B. | 稀释前x、y的物质的量浓度相等 | |
| C. | 随着稀释的进行,y的电离程度减小 | |
| D. | 等体积的x、y分别与足量的锌反应,y放出的氢气多 |
8.用括号内的试剂除去下列各物质中少量的杂质,正确的是( )
| A. | 溴苯中的溴(碘化钾溶液) | B. | 硝基苯中的硝酸(氢氧化钠溶液) | ||
| C. | 乙烷中的乙烯(氢气) | D. | 苯中的甲苯(水) |
18.与下列实验事实所对应的相应结论正确的是
( )
| 实验事实 | 结论 | |
| ① | HCl的水溶液中存在H+和Cl- | HCl是离子化合物 |
| ② | NO2通入水中,发生反应,产物中有HNO3 | NO2是酸性氧化物 |
| ③ | 向FeCl3溶液中加入铜片,溶液逐渐变为蓝色 | 氧化性:Fe3+>Cu2+ |
| ④ | 等物质的量的Na和Al都完全反应,Al失电子多 | 金属性:Al>Na |
| ⑤ | 某无色溶液中加入氢氧化钠浓溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定有NH4+ |
| A. | ①② | B. | ①②④ | C. | ③⑤ | D. | ③④⑤ |
5.下列检验试样中某离子的操作及结论不合理的是( )
| A. | 先加HCl无明显现象,再加BaCl2有白色沉淀,一定有SO42- | |
| B. | 加入稀盐酸产生能使澄清石灰水变浑浊的无味气体,则溶液中一定有CO32- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 做焰色反应,末观察到焰色为紫色,则待测液中一定不含有钾元素 |
2.建设资源节约型、环境友好型社会是政府的工作目标,以下措施中不能体现这一思想的是( )
| A. | 在电解铝工业中添加冰晶石 | |
| B. | 开发太阳能、风能、氢能等清洁能源 | |
| C. | 收集废弃的秸杆等生产沼气 | |
| D. | 为防止电池中的重金属污染土壤,将废旧电池深埋地下 |
3.某同学组装了如图所示的电化学装置,则下列说法正确的是( )


| A. | 图中甲池为原电池装置,Cu电极发生还原反应 | |
| B. | 实验过程中,甲池左侧烧杯中NO3-的浓度不变 | |
| C. | 若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液可能是足量AgNO3溶液 | |
| D. | 若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量不变 |