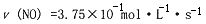题目内容
汽车上的催化转化器,可将尾气中的主要污染物转化成无毒物质,反应为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5kJ?mol-1,在某温度时.,用气体传感器测得不同时间的NO和CO浓度如表:
经分析,得出结论不正确的是( )
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)(×10-4mol?L-1) | 10.0 | 4.05 | 2.50 | 1.50 | 1.00 | 1.00 |
| C(CO)(×10-3mol?L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A、该反应转化较快,具有存实际意义 |
| B、催化转化器在冬季时对废气转化效率比夏季更高 |
| C、2s末的平均反应速率v(NO)=3.75×10-4mol?L-1?S1 |
| D、在该温度下,反应的平衡常数K=5000 |
分析:该反应的正反应为放热反应,升高温度不利于平衡向正向移动,反应速率较快,可适用于废气的处理,计算出平衡时各物质的浓度,结合平衡常数表达式可计算平衡常数,以此解答该题.
解答:解:A.由表中数据可知,当反应至4s时,达到平衡状态,NO的浓度变化较大,说明反应转化较快,可用于尾气处理,故A正确;
B.该反应的正反应为放热反应,升高温度不利于平衡向正向移动,故B正确;
C.2s内的平均反应速率v(NO)=
=3.75×10-4mol?L-1?S1,而2s末应为瞬时速率,故C错误;
D.2NO(g)+2CO(g)=N2(g)+2CO2(g)
初始浓度:10×10-4 3.6×10-3 0 0
变化浓度:9×10-4 9×10-4 4.5×10-4 9×10-4
平衡浓度:1×10-4 2.7×10-3 4.5×10-4 9×10-4
K=
=5000,故D正确.
故选C.
B.该反应的正反应为放热反应,升高温度不利于平衡向正向移动,故B正确;
C.2s内的平均反应速率v(NO)=
| (10-2.5)×10-4mol/L |
| 2s |
D.2NO(g)+2CO(g)=N2(g)+2CO2(g)
初始浓度:10×10-4 3.6×10-3 0 0
变化浓度:9×10-4 9×10-4 4.5×10-4 9×10-4
平衡浓度:1×10-4 2.7×10-3 4.5×10-4 9×10-4
K=
| 4.5×10-4×(9×10-4)2 |
| (1×10-4)2×(2.7×10-3)2 |
故选C.
点评:本题考查化学平衡的调控作用,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意把握反应的特点以及影响因素的判断,易错点为C,注意2s末与2s内的区别.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于催化剂的说法不正确的是( )
| A、温度越高,催化剂的催化效果越好 | B、汽车排气管上的“催化转化器”能减少有害气体排放 | C、催化剂可以改变化学反应速率,但厦应前后质量和化学性质不变 | D、锌与盐酸反应时,加入几滴硫酸铜溶液可加快反应速率,但硫酸铜不作催化剂 |
汽车上的催化转化器可将尾气中的主要污染物转化成无毒物质,反应为:
2NO(g)+2CO(g) N2(g)+2CO2(g) DH=-a kJ/mol(a>0)
N2(g)+2CO2(g) DH=-a kJ/mol(a>0)
在某温度时,用气体传感器测得不同时间的NO和CO浓度如下表:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)/10-4 mol·L-1 |
10.0 |
4.05 |
2.50 |
1.60 |
1.00 |
1.00 |
|
c(CO)/10-3 mol·L-1 |
3.60 |
3.05 |
2.85 |
2.76 |
2.70 |
2.70 |
经分析,得出结论不正确的是
A.2~3 s间的平均反应速率v(NO)=9×10-5 mol/(L·s)
B.催化转化器对废气的转化速率在夏季时比冬季时高
C.若该催化转化器气舱容积为2 L,则达到平衡时反应放出热量1.8a J
D.该温度下,此反应的平衡常数K=5000
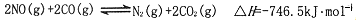 在某温度时.,用气体传感器测得不同时间的NO和CO浓度如表
在某温度时.,用气体传感器测得不同时间的NO和CO浓度如表