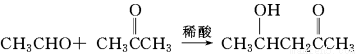题目内容
下列叙述正确的是( )
A.Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱
B.漂白粉和明矾都常用于自来水的处理,二者的作用原理不相同
C.将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀
D.过量的铜与浓硝酸反应,生成的气体只有NO2
B
【解析】Na与冷水反应生成氢气和氢氧化钠:2Na+2H2O=2Na++2OH-+H2↑,铝与氢氧化钠溶液反应可生成氢气:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铁与水蒸气在加热时反应生成氢气:3Fe+4H2O(g)△,Fe3O4+4H2,A项错误;漂白粉利用强氧化性对自来水杀菌、消毒,明矾净水是利用Al3+水解产生胶状物,吸附水中的悬浮物,B项正确;ClO-具有强氧化性,可以将SO2氧化为SO42-,与Ca2+结合生成CaSO4,C项错误;过量的铜与浓硝酸反应,随着反应的进行,硝酸浓度降低,先生成NO2,后生成NO,D项错误。

练习册系列答案
相关题目