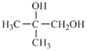题目内容
【题目】设NA代表阿伏加德罗常数的值,下列说法正确的是
A. 常温下28gN2含有的电子数为10NA
B. 标准状况下,22.4LH2O含有的分子数是NA
C. 室温下44gCO2含有的分子数是NA
D. 100mL1mol·L-1盐酸中含有的HCl分子数是0.1NA
【答案】C
【解析】A项,1个N2中含有14个电子;B项,H2O在标准状况下不呈气态,不能用22.4L/mol计算n(H2O);C项,n(CO2)=![]() =1mol;D项,盐酸中不含HCl分子。
=1mol;D项,盐酸中不含HCl分子。
A项,n(N2)=![]() =1mol,1个N2中含有14个电子,28gN2含电子物质的量为14mol,A项错误;B项,H2O在标准状况下不呈气态,不能用22.4L/mol计算n(H2O),B项错误;C项,n(CO2)=
=1mol,1个N2中含有14个电子,28gN2含电子物质的量为14mol,A项错误;B项,H2O在标准状况下不呈气态,不能用22.4L/mol计算n(H2O),B项错误;C项,n(CO2)=![]() =1mol,室温下44gCO2含有分子数是NA,C项正确;D项,n(HCl)=1mol/L
=1mol,室温下44gCO2含有分子数是NA,C项正确;D项,n(HCl)=1mol/L![]() 0.1L=0.1mol,HCl在水分子作用下完全电离成H+和Cl-,盐酸中不含HCl分子,D项错误;答案选C。
0.1L=0.1mol,HCl在水分子作用下完全电离成H+和Cl-,盐酸中不含HCl分子,D项错误;答案选C。

【题目】近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染.
已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574 kJ/mol
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160 kJ/mol
③H2O(g)═H2O(l)△H=﹣44.0 kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式: .
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H=akJmol﹣1 .
在T1℃时,反应进行到不同时间测得各物质的浓度如表:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0﹣20min的平均反应速率V(NO)=;计算该反应的平衡常数K=;
②30min后,只改变某一条件,根据上表中的数据判断改变的条件可能是(填字母编号).
A.通人一定量的CO2 B.加入合适的催化剂 C.适当缩小容器的体积
D.通人一定量的NO E.加入一定量的活性炭
③若50min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率(填“升高”或“降低”),a 0(填“>”或“<”).