题目内容
【题目】25℃时,草酸溶液中部分微粒的物质的量浓度随NaOH溶液的加入pH 的变化如图所示。其中c (H2C2O4) +c (HC2O4-)+ c (C2O42-)=0.1mol/L,下列说法不正确的是
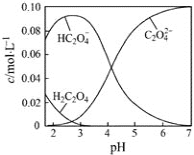
A. H2C2O4的Ka2数量级为10-5
B. NaHC2O4溶液中,c (Na+)>c(HC2O4-)>c (H+)>c (OH-)
C. 0.1mol/L 的H2C2O4溶液,H2C2O4的电离度为80%
D. pH=7.0的溶液中,c (Na+)=0.1 + c(C2O42-) - c (H2C2O4)
【答案】C
【解析】
A项,根据c(HC2O4-)=c(C2O42-)时溶液的pH计算H2C2O4的Ka2;
B项,根据图像知NaHC2O4溶液呈酸性,NaHC2O4溶液中HC2O4-的电离程度大于HC2O4-的水解程度,据此分析判断NaHC2O4溶液中离子浓度的大小顺序;
C项,由图像中0.1mol/LH2C2O4溶液中c(HC2O4-)分析H2C2O4的电离度;
D项,由电荷守恒和c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.1mol/L分析。
A项,H2C2O4的电离方程式为H2C2O4![]() H++HC2O4-、HC2O4-
H++HC2O4-、HC2O4-![]() H++C2O42-,H2C2O4的Ka2=
H++C2O42-,H2C2O4的Ka2=![]() ,根据图像当c(HC2O4-)=c(C2O42-)时溶液的pH介于4和5之间,H2C2O4的Ka2数量级为10-5,A项正确;
,根据图像当c(HC2O4-)=c(C2O42-)时溶液的pH介于4和5之间,H2C2O4的Ka2数量级为10-5,A项正确;
B项,根据图像知NaHC2O4溶液呈酸性,NaHC2O4溶液中HC2O4-的电离程度(HC2O4-![]() H++C2O42-)大于HC2O4-的水解程度(HC2O4-+H2O
H++C2O42-)大于HC2O4-的水解程度(HC2O4-+H2O![]() H2C2O4+OH-),但HC2O4-的电离程度和水解程度都很微弱,NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H+)>c(OH-),B项正确;
H2C2O4+OH-),但HC2O4-的电离程度和水解程度都很微弱,NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H+)>c(OH-),B项正确;
C项,H2C2O4的电离以第一步电离为主,已电离的H2C2O4分子的浓度等于溶液中c(HC2O4-),图像中0.1mol/LH2C2O4溶液中c(HC2O4-)<0.08mol/L,0.1mol/LH2C2O4溶液中H2C2O4的电离度为![]() ×100%<80%,C项错误;
×100%<80%,C项错误;
D项,加入NaOH溶液后溶液中的电荷守恒式为:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),常温下pH=7.0的溶液呈中性,c(H+)=c(OH-),则pH=7.0的溶液中的电荷守恒为c(Na+)=c(HC2O4-)+2c(C2O42-),将c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.1mol/L代入得c(Na+)=0.1+c(C2O42-)-c(H2C2O4),D项正确;
答案选C。

 阅读快车系列答案
阅读快车系列答案