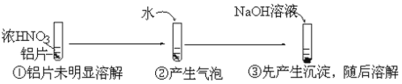
题目内容
【题目】垃圾分类正在全国逐渐推广,垃圾资源化是可持续、绿色发展的重要途径。由金属废料(主要含铁、铜和它们的氧化物)制得碱式碳酸铜和摩尔盐[(NH4)2SO4·FeSO4·xH2O]的工艺流程如下图所示:
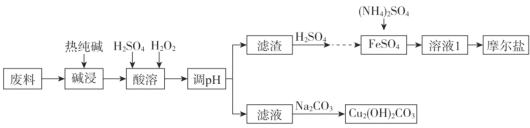
已知:Ksp[Fe(OH)3]=1×10-38 ,Ksp[Cu(OH)2]= 2.2×10-21,一般认为某离子浓度小于或等于10-5mol/L时,该离子转化或去除完全。
请回答下列问题:
(1)热纯碱的作用是_______________,H2O2的电子式为___________。
(2)调pH步骤可选用的试剂为______________。
A.CuO B.Cu(OH)2 C.Fe2O3 D.Fe(OH)3
(3)若所得溶液中c(Cu2+)=0.22 mol·L-1,则需要调节的pH范围是_______________。
(4)溶液1经过加热、蒸发至溶液中出现晶体时,自然冷却即可得到晶体,然后抽滤,用酒精洗涤晶体,酒精洗涤的目的是____________________________________。
(5)写出该流程中生成碱式碳酸铜的离子方程式________________________________。
(6)取3.92g摩尔盐产品,在隔绝空气的条件下加热至135°C时完全失去结晶水,此时固体质量为2.84g,则该摩尔盐结晶水个数x=________。
【答案】去除废料表面的油污 ![]() AB 3~4 除去晶体表面水分 2Cu2++3CO32-+2H2O=Cu2(OH)2CO3↓+2HCO3-(或2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑) 6
AB 3~4 除去晶体表面水分 2Cu2++3CO32-+2H2O=Cu2(OH)2CO3↓+2HCO3-(或2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑) 6
【解析】
加入热的纯碱液,金属废料(主要含铁、铜和它们的氧化物)中的主要成分都不发生反应,所以热的纯碱液的作用只能是去除油污;加入H2SO4、H2O2,铁及氧化物溶解并转化为Fe3+,铜及氧化物溶解生成Cu2+;调pH将Fe3+转化为Fe(OH)3沉淀,用硫酸溶解生成硫酸铁,再加入还原铁粉转化为硫酸亚铁,加入硫酸铵最后得摩尔盐。滤液中含有Cu2+,加入Na2CO3溶液发生双水解反应生成Cu2(OH)2CO3。
(1)由以上分析可知,利用热的纯碱溶液水解使溶液呈较强的碱性,从而达到去除油污的目的,其作用是去除废料表面的油污,H2O2为共价化合价,既存在O—H共价键,又存在O—O共价键,其电子式为![]() 。答案为:去除废料表面的油污;
。答案为:去除废料表面的油污;![]() ;
;
(2)调pH的目的,是将Fe3+转化为Fe(OH)3沉淀,同时不引入新的杂质,可选择CuO、Cu(OH)2,所以可选用的试剂为AB,故答案为:AB;
(3)Ksp[Fe(OH)3]=1×10-38,c(Fe3+)=10-5mol/L,c(OH-)=10-11mol/L,pH=3;若所得溶液中c(Cu2+)=0.22mol·L-1,利用Ksp[Cu(OH)2]=2.2×10-20,可求得c(OH-)=![]()
![]() mol/L,pH=-lg(10-4)=4,则需要调节的pH范围是3~4,故答案为:3~4;
mol/L,pH=-lg(10-4)=4,则需要调节的pH范围是3~4,故答案为:3~4;
(4)自然冷却即可得到晶体,然后抽滤;防烘干时晶体易失去结晶水,所以不能采用烘干的方法,而应用酒精洗涤晶体,酒精洗涤的目的是除去晶体表面水分,故答案为:除去晶体表面水分;
(5)该流程中Cu2+,加入Na2CO3溶液,利用部分离子发生双水解反应生成Cu2(OH)2CO3,离子方程式为2Cu2++3CO32-+2H2O=Cu2(OH)2CO3↓+2HCO3-(或2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑),故答案为:2Cu2++3CO32-+2H2O=Cu2(OH)2CO3↓+2HCO3-(或2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑);
(6)m[(NH4)2SO4·FeSO4]= 2.84g,n[(NH4)2SO4·FeSO4]=![]() =0.01mol,m(H2O)= 3.92g-2.84g=1.08g,n(H2O)=
=0.01mol,m(H2O)= 3.92g-2.84g=1.08g,n(H2O)=![]() =0.06mol,则该摩尔盐结晶水个数x=
=0.06mol,则该摩尔盐结晶水个数x=![]() =6,故答案为:6。
=6,故答案为:6。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案