题目内容
【题目】已知可逆反应CO(g) + H2O (g)CO2(g) + H2(g),在830K温度下达到平衡。
(1)其化学平衡常数K的表达式为K= _______。
(2)830K时,若起始时:c (CO) = 2mol/L,c (H2O)=3mol/L,平衡时CO的转化率为60%, K值为________。
(3)830K,若只将起始时c (H2O)改为6 mol/L,则水蒸气的转化率为_______。
(4)若830K时起始浓度c (CO)=a mol/L,c (H2O)=b mol/L,H2的平衡浓度c (H2)=c mol/L,①a、b、c之间的关系式是_________;
②当a = b时,a= ________c。
【答案】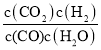 1 25%
1 25% ![]() 2
2
【解析】
(1)根据化学方程式,CO(g)+H2O(g)CO2(g)+H2(g),结合平衡常数概念,得到平衡常数表达式K=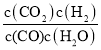 ;
;
(2)平衡时CO的转化率为60%,则CO的浓度变化为1.2mol/L,
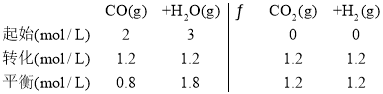
故平衡常数K=1;
(3)设反应的水蒸气的浓度变化量为x mol/L,则
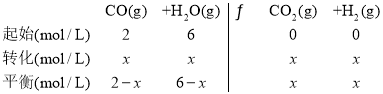
根据平衡常数解得x=1.5,故水蒸气的转化率为![]() =25%;
=25%;
(4)
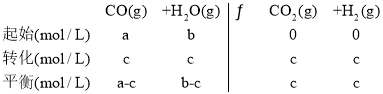
根据平衡常数得![]() ,当a=b时,整理,a=2c。
,当a=b时,整理,a=2c。

【题目】现有A、B、C、D、E五种均可溶于水的固体物质,是由以下提供的几种离子组成![]() 每种离子只能用一次
每种离子只能用一次![]() :
:
阳离子 |
|
阴离子 |
|
现分别进行如下实验:
![]() 将D与E的溶液混合加热,产生有刺激性气味的气体
将D与E的溶液混合加热,产生有刺激性气味的气体
![]() 将B与E的溶液混合,产生白色沉淀,向该沉淀中加入足量的稀硝酸,沉淀部分溶解
将B与E的溶液混合,产生白色沉淀,向该沉淀中加入足量的稀硝酸,沉淀部分溶解
![]() 在常温下用pH试纸测定溶液A的
在常温下用pH试纸测定溶液A的![]()
下列说法不正确的是![]()
A.物质E的化学式为![]() B.物质D中一定含有
B.物质D中一定含有![]()
C.难以确定物质A的组成D.物质C的化学式是![]()
【题目】Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物pCP,探究有关因素对该降解反应速率的影响。
[实验设计]控制pCP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
编号 | 实验目的 | T/K | pH | c/10-3 mol/L | |
H2O2 | Fe2+ | ||||
① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
② | 探究温度对降解反应速率的影响 | ____ | ____ | ____ | ____ |
③ | ____ | 298 | 10 | 6.0 | 0.30 |
[数据处理]实验测得pCP的浓度随时间变化的关系如图:
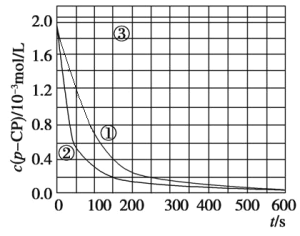
(2)请根据图中实验①曲线,列式并计算降解反应在50~150 s内的反应速率:________。
[解释与结论]
(3)实验①②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:____________。
(4)实验③得出的结论是:pH等于10时,_________________________。