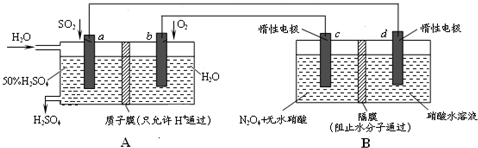
题目内容
13.下列有关电解质溶液中粒子浓度关系正确的是( )| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 将pH=2的盐酸与0.01 mo1•L-1氨水等体积混合:c(NH4+)=c (Cl-) | |
| C. | CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H 2C2O4)] |
分析 A.根据硫酸氢钠溶液中的电荷守恒和物料守恒分析;
B.将pH=2的盐酸与0.01 mo1•L-1氨水等体积混合,两种溶液恰好反应生成氯化铵溶液;
C.碳酸的电离分步进行,以第一步为主,则碳酸氢根离子浓度大于碳酸根离子;
D、含等物质的量的NaHC2O4和Na2C2O4的溶液中存在物料守恒2n(Na+)=3n(C2O42-).
解答 解:A.根据电荷守恒,pH=1的NaHSO4溶液存在:c(Na+)+c(H+)=2c(SO42-)+c(OH-),因为c(Na+)=c(SO42-),所以c(H+)=c(SO42-)+c(OH-),故A正确;
B.将pH=2的盐酸与0.01 mo1•L-1氨水等体积混合,两种溶液恰好反应生成氯化铵溶液,c(NH4+)<c (Cl-),故B错误;
C.H2CO3的第一步电离大于第二步电离,则c(H+)>c(HCO3-)>c(CO32-),但c(HCO3-)不等于2c(CO32-),故C错误;
D、含等物质的量的NaHC2O4和Na2C2O4的溶液中存在物料守恒2n(Na+)=3n(C2O42-),2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H 2C2O4)],故D错误;
故选A.
点评 本题考查了离子浓度大小比较、难溶物溶解平衡应用、弱电解质的电离等知识,题目难度中等,试题知识点较多,充分考查了学生的分析、理解能力,注意掌握电荷守恒、物料守恒的含义,明确难溶物溶解平衡及其应用方法.

练习册系列答案
相关题目
3.海水中蕴藏着丰富的资源.海水综合利用的示意图如图:下列说法正确的是( )
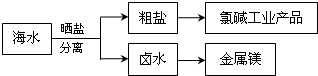

| A. | 通过氯碱工业可生产的产品仅仅为NaOH、Cl2 | |
| B. | 除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→适量盐酸 | |
| C. | 可将MgCl2•6H2O晶体在空气中直接加热脱水得到较纯净的无水MgCl2 | |
| D. | 电解MgCl2溶液可制取金属镁 |
4.下列方程式正确的是( )
| A. | AlCl3 溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| B. | 碳酸的电离方程式:H2CO3?2H++CO32- | |
| C. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3KJ•mol-1 | |
| D. | 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
1.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗下层液体从活塞放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液蒸干 | |
| D. | 两种互不相溶,密度也不相同的液体可以用分液漏斗分离,例如苯和水 |
2.下列金属单质能与硫酸铜溶液反应且不产生气体的是( )
| A. | 金 | B. | 银 | C. | 钠 | D. | 锌 |
 25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示,回答下列问题
25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示,回答下列问题