ћвƒњƒЏ»Ё
A°ҐB°ҐC°ҐD «Ћƒ÷÷≥£Љыµ•÷ £ђ∆дґ‘”¶‘™ЋЎµƒ‘≠„”–т э“јіќ‘ціу£ђ∆д÷–B°ҐD ф”Џ≥£Љыљр ф£ђ”аЊщќ™≥£ЉыїѓЇѕќп£ђJ «“ї÷÷ЇЏ…Ђєћће£ђIµƒ≈®»№“ЇЊя”–їє‘≠–‘£ђA°™JµƒЋщ”–ќп÷ ÷ЃЉд”–»зѕ¬µƒ„™їѓєЎѕµ£®≤њЈ÷Јі”¶≤ъќп °¬‘£©£Ї

£®1£©B‘™ЋЎЇЌC‘™ЋЎµƒЉтµ•јл„”∞лЊґіу–°єЎѕµ « £®”√јл„”ЈыЇ≈±н Њ£©£Ї
£®2£©љЂµ™‘™ЋЎ”лC–ќ≥…µƒїѓЇѕќпNC3Љ”»лЋЃ÷–≤ъ…ъ єЇм…Ђ ѓ»п ‘÷љ±дјґµƒ∆шће£ђ–і≥цЄ√Јі”¶µƒїѓ—ІЈљ≥ћ љ £ї
£®3£©”…Eµƒ±•ЇЌ»№“Їµќ»лЈ–ЋЃ÷––ќ≥…ЌЄ√ч“Їће£ђ‘ўљЂіЋ“Їће„∞»лU–Ќє№£ђ≤Ґ‘ЏU–Ќє№µƒЅљґЋ≤е»лµзЉЂ£ђљ”Ќ®÷±Ѕчµз£ђ‘Џ—фЉЂґЋњ…єџ≤мµљµƒѕ÷ѕу « £ї
£®4£©љЂ ЅњJЉ”»лЋбїѓµƒH2O2µƒ»№“Ї÷–£ђJ»№љв…ъ≥…Ћьµƒ+2Љџјл„”£ђЄ√Јі”¶µƒјл„”Јљ≥ћ љ «
£ї
£®5£©ѕтЇђ”–0£Ѓ1 mol Gµƒ»№“Ї÷–µќЉ”5 mol/L µƒ—ќЋб»№“Ї£ђµ√µљ≥Ѕµн3£Ѓ9 g £ђ‘тЉ”»л—ќЋбµƒћеїэњ…ƒ№ќ™ °£
£®1£©r£®Al3+£© < r£®Cl‑£©£®їтAl3+ < Cl‑£©£®2£©NCl3+ 3H2O = NH3°ь + 3HClO£®3£©ЇмЇ÷…Ђ±д«≥£®ір”–Cl2…ъ≥…њ…Єш1Ј÷£©£®4£©MnO2 + H2O2 + 2H+ = Mn2+ + O2°ь + 2H2O£®5£©10 mLЇЌ50 mL
°Њљвќц°њ
‘ћвЈ÷ќц£ЇIµƒ≈®»№“ЇЊя”–їє‘≠–‘£ђ”¶ќ™HCl£ђJ «“ї÷÷ЇЏ…Ђєћће£ђњ…”л≈®—ќЋбЈі”¶£ђ”¶ќ™MnO2£ђґю’яЈі”¶…ъ≥…Cќ™Cl2£ђDќ™≥£Љыљр ф£ђњ…”лЋЃ’ф∆шЈі”¶£ђ”¶ќ™Fe£ђ‘тEќ™FeCl3£ђAќ™H2£ђFќ™Fe3O4£ђBƒ№”лFe3O4‘ЏЄяќ¬ѕ¬Јі”¶£ђ«“ƒ№”лNaOH»№“ЇЈі”¶£ђ‘тBќ™Al£ђGќ™NaAlO2£ђHќ™Al2O3£ђ‘т£®1£©”…“‘…ѕЈ÷ќцњ…÷™B‘™ЋЎµƒЉтµ•јл„”ќ™Al3+£ђCќ™Cl£≠£ђAl3+”–ЅљЄцµз„”≤г£ђґшCl£≠”–»эЄцµз„”≤г£ђє r£®Al3+£©< r£®Cl‑£©£®2£©Їм…Ђ ѓ»п ‘÷љ±дјґµƒ∆шћеЉіќ™∞±∆ш£ђCќ™Cl2£ђЄщЊЁ‘≠„” э ЎЇг≈д∆љЈі”¶Јљ≥ћ љ£ЇNCl3+ 3H2O = NH3°ь + 3HclO£®3£©Eќ™FeCl3£ђ µ—й “њ…”√љЂ±•ЇЌFeCl3»№“Ї÷рµќЉ”»лЈ–ЋЃµƒЈљЈ®÷∆±Є«в—хїѓћъљЇће£ђљЇћеЊя”–µз”Њѕ÷ѕу£ђљЇћеЅ£„”іш’эµзЇ…£ђЌвЉ”µз‘і£ђњ…ѕтµз‘іЄЇЉЂ“∆ґѓ£ђ‘т—фЉЂЇм…ЂЉ”…о£®4£©Jќ™MnO2£ђЄщЊЁћв“вњ…÷™Јі”¶µƒјл„”Јљ≥ћ љќ™MnO2+H2O2+2H+®TMn2++O2°ь+2H2O£®5£©Gќ™NaAlO2£ђЉ”»л…ўЅњ—ќЋб ±£ђ—ќЋб”л∆Ђ¬ЅЋбƒ∆Јі”¶…ъ≥…«в—хїѓ¬Ѕ≥Ѕµн£ђNaAl(OH)4+HCl==NaCl+H2O+Al(OH)3°э£ђ…иЉ”»лnL—ќЋб
n°Ѕ5mol/L  Љі
Љі £Ї5n=1£Ї1£ђn=0.01L=10mL£ђЉ”»лєэЅњ—ќЋб ±—ќЋбѕ»”л∆Ђ¬ЅЋбƒ∆Ќк»ЂЈі”¶£ђ…ъ≥…«в—хїѓ¬Ѕ≥Ѕµн£ђ—ќЋб‘Џ”л«в—хїѓ¬Ѕ≥ЅµнЈі”¶£ђ є≥Ѕµн¬э¬эЉх…ў£ђµЏ“ї≤љ0.1mol∆Ђ¬ЅЋбƒ∆Ќк»ЂЈі”¶£ђNaAl(OH)4+HCl==NaCl+H2O+Al(OH)3°э £ђѕыЇƒ5mol/Lµƒ—ќЋб»№“Ї20ml£ђЉі0.1mol£ђ…ъ≥…«в—хїѓ¬Ѕ0.1mol£ђ÷ Ѕњќ™7.8g£ђ”÷Јі”¶Їуµ√µљ≥Ѕµн3.9g£ђЉіµЏґю≤љЈі”¶«в—хїѓ¬Ѕ7.8g-3.9g=3.9g£ђ…иµЏґю≤љѕыЇƒmL—ќЋб£Ї 3HCl+Al(OH)3=AlCl3+3H2O£ђ
£Ї5n=1£Ї1£ђn=0.01L=10mL£ђЉ”»лєэЅњ—ќЋб ±—ќЋбѕ»”л∆Ђ¬ЅЋбƒ∆Ќк»ЂЈі”¶£ђ…ъ≥…«в—хїѓ¬Ѕ≥Ѕµн£ђ—ќЋб‘Џ”л«в—хїѓ¬Ѕ≥ЅµнЈі”¶£ђ є≥Ѕµн¬э¬эЉх…ў£ђµЏ“ї≤љ0.1mol∆Ђ¬ЅЋбƒ∆Ќк»ЂЈі”¶£ђNaAl(OH)4+HCl==NaCl+H2O+Al(OH)3°э £ђѕыЇƒ5mol/Lµƒ—ќЋб»№“Ї20ml£ђЉі0.1mol£ђ…ъ≥…«в—хїѓ¬Ѕ0.1mol£ђ÷ Ѕњќ™7.8g£ђ”÷Јі”¶Їуµ√µљ≥Ѕµн3.9g£ђЉіµЏґю≤љЈі”¶«в—хїѓ¬Ѕ7.8g-3.9g=3.9g£ђ…иµЏґю≤љѕыЇƒmL—ќЋб£Ї 3HCl+Al(OH)3=AlCl3+3H2O£ђ
m°Ѕ5 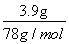 Љі
Љі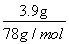 £Ї5m=1£Ї3£ђm=30mL
£Ї5m=1£Ї3£ђm=30mL
“їґю≤љ„№ѕыЇƒ—ќЋб50mL£ђє Љ”»л—ќЋбµƒћеїэњ…ƒ№ќ™10 mLЇЌ50 mL°£
њЉµг£ЇќёїъќпµƒЌ∆ґѕ

 њЏЋгƒ№ ÷ѕµЅ–ір∞Є
њЏЋгƒ№ ÷ѕµЅ–ір∞Є






