题目内容
【题目】综合利用海水可以制备食盐、纯碱、金属镁等物质,其流程如图所示: 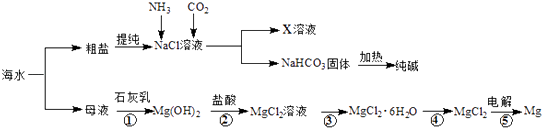
(1)反应①~⑤中,属于氧化还原反应的是(填编号).
(2)写出反应②的离子方程式 .
(3)X溶液中的主要阳离子是Na+和 .
(4)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下: ①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3溶液;③;④加适量盐酸;⑤ . (请补全缺少的实验步骤)
(5)检验纯碱样品中是否含NaCl应选用的试剂是 .
【答案】
(1)⑤
(2)Mg(OH)2+2H+=Mg2++2H2O;
(3)NH4+
(4)过滤;蒸发结晶
(5)稀硝酸、AgNO3溶液
【解析】解:(1)①石灰乳与氯化镁反应生成氢氧化镁沉淀和氯化钙,元素化合价不变,非氧化还原反应;
②氢氧化镁沉淀与盐酸反应生成氯化镁和水,元素化合价不变,非氧化还原反应;
③氯化镁溶液蒸发浓缩得到氯化镁晶体,元素化合价不变,非氧化还原反应;
④氯化镁晶体分解得到氯化镁和水,元素化合价不变,非氧化还原反应;
⑤电解氯化镁得到镁和氯气,元素化合价发生变化,氧化还原反应;
故选⑤;(2)氢氧化镁沉淀与盐酸反应生成氯化镁和水,方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,离子方程式为:
Mg(OH)2+2H+=Mg2++2H2O;
所以答案是:Mg(OH)2+2H+=Mg2++2H2O;(3)向氯化钠溶液中依次通入氨气、二氧化碳,发生反应:NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NH4Cl+NaHCO3↓,所以溶液中含有NH4Cl和NaHCO3,则溶液中的主要阳离子是Na+和NH4+;
所以答案是:NH4+;(4)首先要把粗盐溶于水形成溶液,然后镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,Ca2++CO32﹣=CaCO3↓,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,Ba2++CO32﹣=BaCO3↓,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,最后经蒸发操作得到较纯净的氯化钠;
所以答案是:过滤;蒸发结晶;(5)氯离子能和硝酸酸化的硝酸银溶液反应生成氯化银白色沉淀,所以检验纯碱样品中是否含NaCl应选用的试剂是稀硝酸、AgNO3溶液;
所以答案是:稀硝酸、AgNO3溶液.





