题目内容
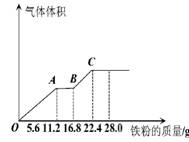
常温下,某200mL稀硫酸和稀硝酸的混合溶液最多能溶解 19.2g铜粉(已知硝酸只被还原为NO气体),若再取等体积的该混合酸向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列有关分析错误的是
A.原混合酸中NO3—的物质的量为0.2 mol
B.原混合酸中H2SO4物质的量浓度为2 mol/L
C.取25mL原混合酸加水稀释至1 L后溶液的pH =1
D.OA段与BC段反应中电子转移的物质的量之比为3:1
【答案】
C
【解析】
试题分析:A、铜粉最多能溶解19.2克,是0.3mol,失去0.6 mol电子,说明含硝酸根离子0.2 mol,考虑生成硫酸铜,则至少有硝酸0.2 mol,硫酸0.3 mol;铁粉则最多能溶解22.4g,是0.4 mol,失去0.8 mol电子.说明还有0.1 mol硫酸反应生成硫酸亚铁和氢气,则有0.2 mol硝酸和0.4 mol硫酸亚铁。因此,原混合酸中NO3-的物质的量为0.2mol,硝酸浓度是1 mol /L,正确;B、同理可知:硫酸的物质的量为0.4mol,硫酸浓度是2mol/L, B正确;C、原混合酸中C(H+)=5mol/L,稀释50倍后,C(H+)=0.1 mol/L,pH=1,正确;D、由AB段气体数量不变可知,此阶段是Fe3+与单质铁之间的反应,BC阶段发生的是H+与单质铁的反应,OA段消耗0.2mol铁且此阶段反应结束时,溶液中还剩余有H+,说明此时溶液中NO3-全部反应完了,OA段电子转移的物质的量为0.6mol,BC阶电子转移的物质的量为0.2mol,两者的物质的量之比为3:1,错误。
考点:本题考查硝酸的性质及计算、图像的分析。

练习册系列答案
相关题目
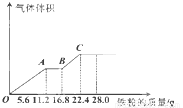
 常温下,某200mL稀硫酸和稀硝酸的混合溶液最多能溶解 19.2g铜粉(已知硝酸只被还原为NO气体),若再取等体积的该混合酸向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列有关分析错误的是( )
常温下,某200mL稀硫酸和稀硝酸的混合溶液最多能溶解 19.2g铜粉(已知硝酸只被还原为NO气体),若再取等体积的该混合酸向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列有关分析错误的是( )| A、原混合酸中NO3-的物质的量为0.2mol | B、原混合酸中H2SO4物质的量浓度为2mol/L | C、取25mL原混合酸加水稀释至1L后溶液的pH=1 | D、OA段与BC段反应中电子转移的物质的量之比为3:1 |
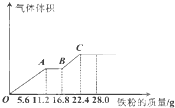
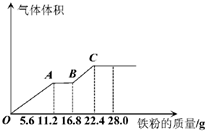 常温下,某200mL稀硫酸和稀硝酸的混合溶液最多能溶解19.2g铜粉(已知硝酸只被还原为NO气体),若再取等体积的该混合酸向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列有关分析错误的是( )
常温下,某200mL稀硫酸和稀硝酸的混合溶液最多能溶解19.2g铜粉(已知硝酸只被还原为NO气体),若再取等体积的该混合酸向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列有关分析错误的是( )