题目内容
三种常见元素结构信息如下表,试根据信息回答有关问题:
|
元素 |
A |
B |
C |
|
结构信息 |
基态原子核外有两个电子层,最外层有3个未成对的电子 |
基态原子的M层有1对成对的p电子 |
基态原子核外电子排布为[Ar]3s104sx,有+1、+2两种常见化合价 |
(1)写出B原子的基态电子排布式 ;(1分)
(2)用氢键表示式写出A的氢化物溶液中存在的所有氢键 (2分);A的氢化物分子结合一个H+形成阳离子后,其键角 (填写“变大”、“变小”、“不变”);(1分)
(3)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,
(4) 科学家通过X射线推测胆矾中微粒间的作用力,胆矾的结构示意图可简单表示如下:

则胆矾晶体中含有
A.配位键 B.离子键 C.极性共价键 D. 金属键 E.氢键 F.非极性共价键
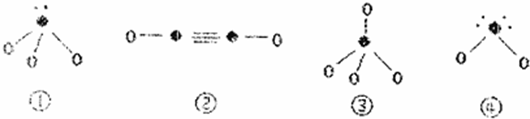
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“·”表示没有形成共价键的最外层电子,短线表示共价键。

在以上分子中,中心原子采用 杂化形成化学键是 (填写序号)。
杂化形成化学键是 (填写序号)。
(1)1s22s22p63s23p4 (2)N—H…N- N—H…O- O—H…N- O—H…O- 变大 (3)[Cu(NH3)4]SO4 (4) ABCE (5) ①③④
【解析】
试题分析:基态原子核外有两个电子层,最外层有3个未成对的电子,这说明A是氮元素。基态原子的M层有1对成对的p电子,所以B是S元素。基态原子核外电子排布为[Ar]3s104sx,有+1、+2两种常见化合价,则C是铜元素。
(1)根据构造原理可知,B原子的基态电子排布式1s22s22p63s23p4。
(2)由于氮元素和氧元素都能形成氢键,所以A的氢化物溶液中存在的所有氢键是N—H…N- N—H…O- O—H…N- O—H…O-;A的氢化物分子结合一个H+形成阳离子后,其键角由107°变为109°28′,即键角变大。
(3)氨气能和铜离子形成配位健,所以化学式是[Cu(NH3)4]SO4。
(4)根据胆矾的结构简式可知,分子中存在的作用力由配位键、离子键、极性共价键、氢键,答案选ABCE。
(5)①是H3O+,②乙炔,③是甲烷,④水分子,所以中心原子是sp3杂化的是①③④。
考点:考查核外电子排布、配位健、氢键以及杂化轨道类型的有关判断
点评:该题是高考中的常见题型和考点,属于中等难度试题的考查。试题综合性强,难易适中,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理和规范答题能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

三种常见元素结构信息如下表,试根据信息回答有关问题:
| 元素 | A | B | C |
| 结构信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3s104sx,有+1、+2两种常见化合价 |
(2)用氢键表示式写出A的氢化物溶液中存在的所有氢键 (2分);A的氢化物分子结合一个H+形成阳离子后,其键角 (填写“变大”、“变小”、“不变”);(1分)
(3)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,
(4) 科学家通过X射线推测胆矾中微粒间的作用力,胆矾的结构示意图可简单表示如下:

则胆矾晶体中含有
A.配位键 B.离子键 C.极性共价键 D. 金属键 E.氢键 F.非极性共价键
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“·”表示没有形成共价键的最外层电子,短线表示共价键。

在以上分子中,中心原子采用
 杂化形成化学键是 (填写序号)。
杂化形成化学键是 (填写序号)。 三种常见元素结构信息如下表,试根据信息回答有关问题:
|
元素 |
A |
B |
C |
|
结构信息 |
基态原子核外有两个电子层,最外层有3个未成对的电子 |
基态原子的M层有1对成对的p电子 |
基态原子核外电子排布为[Ar]3s104sx,有+1、+2两种常见化合价 |
(1)写出B原子的基态电子排布式 ;
(2)用氢键表示式写出A的氢化物溶液中存在的氢键 (任写一种);A的氢化物分子结合一个H+形成阳离子后,其键角 (填写“变大”、“变小”、“不变”);
(3)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况 ;
(4)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“·”表示没有形成共价键的最外层电子,短线表示共价键。
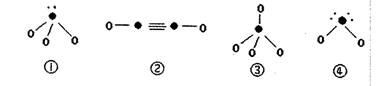
在以上分子中,中心原子采用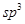 杂化形成化学键是 (填写序号);在②的分子中有 个
杂化形成化学键是 (填写序号);在②的分子中有 个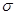 键和 个
键和 个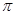 键。
键。
三种常见元素结构信息如下表,试根据信息回答有关问题:
| 元素 | A | B | C |
| 结构信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3s104sx,有+1、+2两种常见化合价 |
(1)写出B原子的基态电子排布式 ;
(2)用氢键表示式写出A的氢化物溶液中存在的氢键 (任写一种);A的氢化物分子结合一个H+形成阳离子后,其键角 (填写“变大”、“变小”、“不变”);
(3)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况 ;
(4)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“·”表示没有形成共价键的最外层电子,短线表示共价键。
在以上分子中,中心原子采用![]() 杂化形成化学键是 (填写序号);在②的分子中有 个
杂化形成化学键是 (填写序号);在②的分子中有 个![]() 键和 个
键和 个![]() 键。
键。