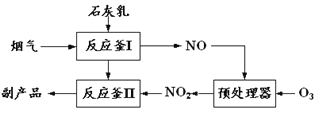
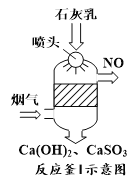
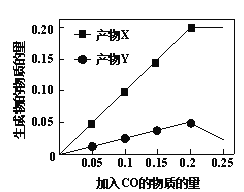
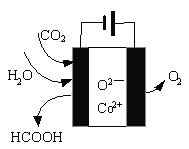
题目内容
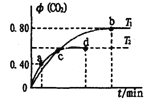
【题目】常温下,向1L0.100mol·L-1的H2C2O4溶液中加入NaOH固体的过程中,部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的关系一定不正确的是

A. pH=3的溶液中:c(H2C2O4)+c(C2O42-)<c(HC2O4ˉ)
B. c(HC2O4ˉ)=c(C2O42-)的溶液中:c(Na+)<0. 100 mol·L-1+c(HC2O4ˉ)
C. 随着NaOH溶液的加入,![]() 减小
减小
D. c(Na+)=0.100mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OHˉ)+c(C2O42-)
【答案】C
【解析】从图像分析可知,pH=3的溶液中:c(H2C2O4)+c(C2O42-)<c(HC2O4ˉ),A正确;从图像看出,溶液显酸性,c(H+)> c(OHˉ),根据电荷守恒:c(H+)+c(Na+)= 2c(C2O42-)+ c(HC2O4ˉ)+ c(OHˉ)可知,c(Na+)<2c(C2O42-)+ c(HC2O4ˉ);而H2C2O4的浓度0.100mol·L-1,且为弱酸,所以2c(C2O42-)<0.100mol·L-1,因此c(Na+)<0. 100 mol·L-1+c(HC2O4ˉ),B正确;草酸的电离平衡常数K1= c(H+)×c(HC2O4ˉ)/ c(H2C2O4),K2= c(H+)×c(C2O42-)/ c(HC2O4ˉ);所以![]() 变形为c(H+)×c(HC2O4ˉ)×c(H+)×c(C2O42-)/ c(H2C2O4) ×c(HC2O4ˉ)=1/(K1×K2),电离平衡常数只受温度的影响,随着NaOH溶液的加入,
变形为c(H+)×c(HC2O4ˉ)×c(H+)×c(C2O42-)/ c(H2C2O4) ×c(HC2O4ˉ)=1/(K1×K2),电离平衡常数只受温度的影响,随着NaOH溶液的加入,![]() 不变,C错误;c(Na+)=0.100mol·L-1的溶液为NaHC2O4溶液,电荷守恒:c(H+)+c(Na+)= 2c(C2O42-)+ c(HC2O4ˉ)+ c(OHˉ),物料守恒:c(Na+)= c(C2O42-)+ c(HC2O4ˉ)+ c(H2C2O4),两式消去c(Na+),得c(H+)+c(H2C2O4)=c(OHˉ)+c(C2O42-),D正确;正确答案C。
不变,C错误;c(Na+)=0.100mol·L-1的溶液为NaHC2O4溶液,电荷守恒:c(H+)+c(Na+)= 2c(C2O42-)+ c(HC2O4ˉ)+ c(OHˉ),物料守恒:c(Na+)= c(C2O42-)+ c(HC2O4ˉ)+ c(H2C2O4),两式消去c(Na+),得c(H+)+c(H2C2O4)=c(OHˉ)+c(C2O42-),D正确;正确答案C。

【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
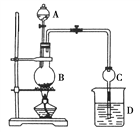
已知:①无水氯化钙可与乙醇形成微溶于水的CaCl2·6C2H5OH;
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用:________________;若用同位素18O示踪法确定反应的断键规律,写出能表示18O位置的化学方程式:__________________。
(2)球形干燥管C的作用是__________。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)______________;反应结束后D中的现象是__________。
(3)该小组同学在实验时加入过量的乙醇,目的是____________________,同时慢慢滴加乙酸并加热蒸馏,原因是_______________________。
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出____________;再加入(此空从下列选项中选择)________;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰
C.无水硫酸钠 D.生石灰