题目内容
反应A2(g)+2B2(g) 2AB2(g)的ΔH<0,下列说法正确的是( )
2AB2(g)的ΔH<0,下列说法正确的是( )
A.升高温度,正反应速率增加,逆反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
【答案】
B
【解析】
试题分析:升高温度,正逆反应速率都是增大的,A不正确,B正确;正反应是体积减小的、放热的可逆反应,所以降低温度或增大压强,有利于该反应平衡正向移动,C、D都是错误的,答案选B。
考点:考查外界条件对反应速率和平衡状态的影响
点评:本题是基础性知识的考查,难度不大。主要是有利于培养学生的答题能力,提高学生学习化学的兴趣和学习积极性。

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
下列有关图象的分析正确的是( )
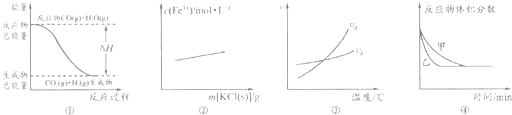

| A、图①表示反应“CO(g)+H2O(g)?CO2(g)+H2(g)”中的△H大于0 | B、图②可表示反应“3KSCN+FeCl3?Fe(SCN)3+3KCl”向正反应方向移动 | C、图③表示反应“A2(g)+3B2(g)?3AB3(g)”的△H小于0 | D、图④可表示压强对反应‘‘2A(g)+2B(g)?3C(g)+D(s)”的影响,且乙的压强大 |
已知反应A2(g)+2B(s) A2B2(g) △H<0,下列说法正确的是( )
A2B2(g) △H<0,下列说法正确的是( )
| A.升高温度,化学平衡向正反应方向移动 |
| B.增大压强,正反应与逆反应速率均增大 |
| C.增大压强,化学平衡向正反应方向移动 |
| D.增大B的物质的量,化学平衡向正反应方向移动 |

 A2B2(g) △H<0,下列说法正确的是 ( )
A2B2(g) △H<0,下列说法正确的是 ( )