题目内容
化学上以12C原子质量的(1)这时C、N、O的相对原子质量将分别为多少?
(2)这时的阿伏加德罗常数值为多少?
(3)这时气体摩尔体积(标准状况下)应为多少?
(4)由新提案所确定的与1 mol H2恰好反应时所需O2的质量是多少克?
(1)C:31.6 N:36.87 O:42.11
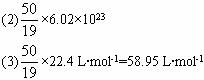
(4)42.11 g
解析:设12C的质量为x g,则F原子质量为![]() x g。根据定义,若A原子的质量为a g,其相对原子质量
x g。根据定义,若A原子的质量为a g,其相对原子质量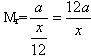 ,新提案所确定的相对原子质量
,新提案所确定的相对原子质量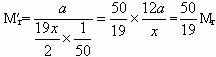 。将C、N、O的相对原子质量分别代入M′r=
。将C、N、O的相对原子质量分别代入M′r=![]() Mr,就可算出新提案所确定的C、N、O的相对原子质量。这时的阿伏加德罗常数
Mr,就可算出新提案所确定的C、N、O的相对原子质量。这时的阿伏加德罗常数![]() ;气体摩尔体积
;气体摩尔体积![]() ;这时的0.5 mol O2的质量为42.11 g。
;这时的0.5 mol O2的质量为42.11 g。

练习册系列答案
相关题目